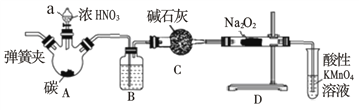
题目内容
【题目】碳和硫的化合物在生产生活中的应用非常广泛。
(1)用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-566.0 kJ·mol-1
2CO2(g) ΔH2=-566.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
则2H2(g)+SO2(g)![]() S(g)+2H2O(g) ΔH4=__________。
S(g)+2H2O(g) ΔH4=__________。
(2)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
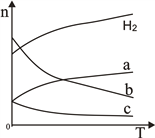
①该反应为____反应(填“吸热”或“放热”)。
②曲线c表示的物质为____________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________【要求答2条】。
④恒温恒容下,能够说明该反应已达到平衡的是_______(填序号);
A.容器内的压强不发生变化
B.混合气体的密度不发生变化
C.n(CO2):n(H2):n(C2H4):n(H2O)=2:6:1:4
D.单位时间内生成6molH2,同时生成4 molH2O
(3)欲用1 L Na2CO3溶液将6.99gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________________。(忽略溶液体积的变化)[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液液呈中性,则氨水的电离平衡常数Kb=______________。
【答案】 +90.4 kJ/mol 放热 C2H4或乙烯 增大压强;或在压强不变的条件下减小n(CO2):n(H2)的投料比(即增加H2的浓度);或及时分离产物(如分离出水) AD 0.33 mol/L (2×10-9)/(a-0.02)
【解析】(1)①2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
②2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-566.0 kJ·mol-1
2CO2(g) ΔH2=-566.0 kJ·mol-1
③2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
由③+①-②得2H2(g)+SO2(g)![]() S(g)+2H2O(g),则ΔH4=ΔH3+ΔH1-ΔH2=-483.6kJ·mol-1+8.0 kJ·mol-1-(-566.0 kJ·mol-1)=+90.4 kJ/mol。
S(g)+2H2O(g),则ΔH4=ΔH3+ΔH1-ΔH2=-483.6kJ·mol-1+8.0 kJ·mol-1-(-566.0 kJ·mol-1)=+90.4 kJ/mol。
(2)①由图像可知,当温度升高时,平衡混合物中氢气的物质的量增加,所以升高温度,化学平衡向逆反应方向移动,故该反应为放热反应。
②因为起始时,按n(CO2):n(H2)=1:3投料,故在平衡混合物中,C2H4与H2O的物质的量之比为1:4.由曲线的变化趋势可知,曲线a表示的物质是CO2,则曲线c表示的物质为C2H4(或乙烯)。
③为提高CO2的平衡转化率,除改变温度外,因为正反应是气体分子数减少的反应,故还可采取的措施是增大压强;或在压强不变的条件下减小n(CO2):n(H2)的投料比(即增加H2的浓度);或及时分离产物(如分离出水)。
④恒温恒容下,A.压强是变量,容器内的压强不发生变化,表明反应达到平衡;B.混合气体的密度一直不发生变化,故不能根据密度判断平衡状态;C.n(CO2):n(H2):n(C2H4):n(H2O)=2:6:1:4,不能说明各组分的浓度保持不变;D.单位时间内生成6molH2、同时生成4 molH2O,表明正反应速率和逆反应速率相等。综上所述,能够说明该反应已达到平衡的是AD;
(3)6.99gBaSO4固体的物质的量为0.03mol,将其完全转化为BaCO3,需要消耗0.03mol Na2CO3. BaSO4完全溶解于1 L Na2CO3溶液后,c(SO42-)=0.03mol/L,则此溶液中c(Ba2+)不大于![]() mol/L,由此计算出该溶液中,c(CO32-)至少为
mol/L,由此计算出该溶液中,c(CO32-)至少为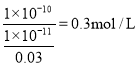 。因此,欲用1 L Na2CO3溶液将6.99gBaSO4固体全都转化为BaCO3,所用的Na2CO3溶液的物质的量浓度至少为
。因此,欲用1 L Na2CO3溶液将6.99gBaSO4固体全都转化为BaCO3,所用的Na2CO3溶液的物质的量浓度至少为![]() 0.33 mol/L。
0.33 mol/L。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液液呈中性,则c(OH-)=1×10-7mol/L,根据电荷守恒可知,c(NH4+)=c(Cl-)=0.5![]() 0.02 mol·L-1=0.01 mol·L-1,由物料守恒得c(NH3H2O)=(0.5a-0.01) mol·L-1,则氨水的电离平衡常数Kb=
0.02 mol·L-1=0.01 mol·L-1,由物料守恒得c(NH3H2O)=(0.5a-0.01) mol·L-1,则氨水的电离平衡常数Kb= ![]() (2×10-9)/(a-0.02)。
(2×10-9)/(a-0.02)。

【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=![]() ,它所对应的化学反应为:__________________。
,它所对应的化学反应为:__________________。
(2)已知在一定温度下,
①C(s)+CO2(g)![]() 2CO(g) ΔH1=a kJ/mol 平衡常数K1;
2CO(g) ΔH1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)![]() CO(g)+H2(g) ΔH3 平衡常数K3。
CO(g)+H2(g) ΔH3 平衡常数K3。
则K1、K2、K3之间的关系是________,ΔH3=__________________(用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是______反应(填“吸热”或“放热”),若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为________。
(4)高炉炼铁产生的废气中的![]() 可进行回收,使其在一定条件下和
可进行回收,使其在一定条件下和![]() 反应制备甲醇:
反应制备甲醇: ![]() 。请回答下列问题;
。请回答下列问题;
①若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 |
| 能量变化( |
甲 | 1 |
|
| 放出 |
乙 | 1 |
|
| 放出 |
丙 | 2 |
|
| 放出 |
则下列关系正确的是__________。
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
e.该反应若生成1![]()
![]() ,则放出(
,则放出(![]() 热量
热量
②若在一体积可变的密闭容器中充入1![]()
![]() 、2
、2![]()
![]() 和1
和1![]()
![]() ,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。
,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。