题目内容
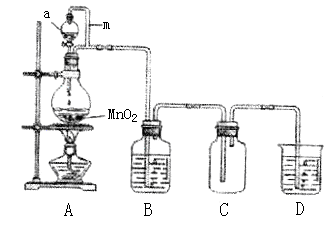
(14分)瑞典化学家舍勒在研究软锰矿(主要成分是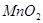 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
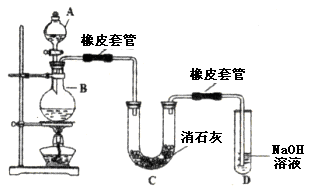
(1)A仪器的名称是__________,所盛试剂是__________,B中发生反应的化学方程式是__________。
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得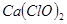 产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成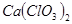 ,为避免此副反应的发生,可采取的措施是______________________________。
,为避免此副反应的发生,可采取的措施是______________________________。
②试判断另一个副反应(写出此反应方程式):____________________。为避免此副反应发生,应采取的措施是______________________________。
(4)漂粉精同盐酸作用产生氯气: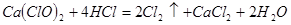 ,该反应中每生成
,该反应中每生成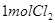 ,转移电子的物质的量为__________
,转移电子的物质的量为__________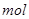 ,被氧化的
,被氧化的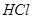 的物质的量为__________
的物质的量为__________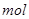 。有效氯是漂粉精中有效
。有效氯是漂粉精中有效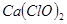 的含量大小的标志。已知:
的含量大小的标志。已知:
有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)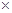 100%,该漂粉精的有效氯为65%,则该漂粉精中
100%,该漂粉精的有效氯为65%,则该漂粉精中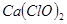 的质量分数为__________(保留一位小数)。
的质量分数为__________(保留一位小数)。
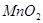 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)A仪器的名称是__________,所盛试剂是__________,B中发生反应的化学方程式是__________。
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得
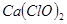 产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:①温度较高时氯气与消石灰反应生成
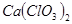 ,为避免此副反应的发生,可采取的措施是______________________________。
,为避免此副反应的发生,可采取的措施是______________________________。②试判断另一个副反应(写出此反应方程式):____________________。为避免此副反应发生,应采取的措施是______________________________。
(4)漂粉精同盐酸作用产生氯气:
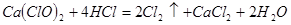 ,该反应中每生成
,该反应中每生成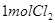 ,转移电子的物质的量为__________
,转移电子的物质的量为__________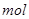 ,被氧化的
,被氧化的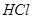 的物质的量为__________
的物质的量为__________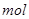 。有效氯是漂粉精中有效
。有效氯是漂粉精中有效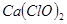 的含量大小的标志。已知:
的含量大小的标志。已知:有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)
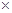 100%,该漂粉精的有效氯为65%,则该漂粉精中
100%,该漂粉精的有效氯为65%,则该漂粉精中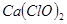 的质量分数为__________(保留一位小数)。
的质量分数为__________(保留一位小数)。1)分液漏斗,浓盐酸,
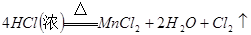 ,
,
(2)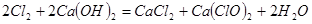 。
。
(3)①将U形管置于冷水浴中。
②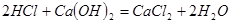 。在B、C之间增加一个饱和食盐水洗气装置。
。在B、C之间增加一个饱和食盐水洗气装置。
(4)1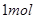 65.5%
65.5%

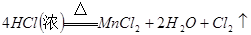 ,
,(2)
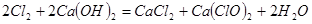 。
。(3)①将U形管置于冷水浴中。
②
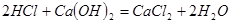 。在B、C之间增加一个饱和食盐水洗气装置。
。在B、C之间增加一个饱和食盐水洗气装置。(4)1
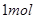 65.5%
65.5%(1)A仪器的名称是分液漏斗,所盛试剂是浓盐酸,B中发生反应的化学方程式是
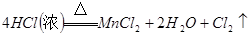 ;
;
(2)漂白粉将在U形管中产生,其化学方程式是: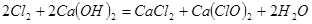
(3)①温度较高时氯气与消石灰反应生成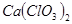 ,为避免此副反应的发生,可采取的措施是:将U形管置于冷水浴中。
,为避免此副反应的发生,可采取的措施是:将U形管置于冷水浴中。
②另一个副反应(写出此反应方程式):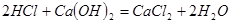 ;为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置。
;为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置。
(4)漂粉精同盐酸作用产生氯气: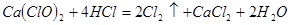 ,该反应中每生成
,该反应中每生成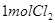 ,转移电子的物质的量为
,转移电子的物质的量为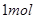 ,被氧化的
,被氧化的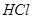 的物质的量为
的物质的量为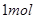 ;
;

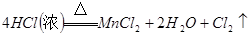 ;
;(2)漂白粉将在U形管中产生,其化学方程式是:
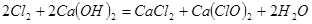
(3)①温度较高时氯气与消石灰反应生成
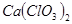 ,为避免此副反应的发生,可采取的措施是:将U形管置于冷水浴中。
,为避免此副反应的发生,可采取的措施是:将U形管置于冷水浴中。②另一个副反应(写出此反应方程式):
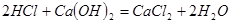 ;为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置。
;为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置。(4)漂粉精同盐酸作用产生氯气:
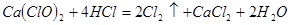 ,该反应中每生成
,该反应中每生成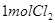 ,转移电子的物质的量为
,转移电子的物质的量为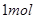 ,被氧化的
,被氧化的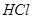 的物质的量为
的物质的量为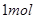 ;
;
练习册系列答案
相关题目
 的是 。
的是 。