题目内容
【题目】加热5.00 g的碳酸钠和碳酸氢钠的混合物至反应完全,混合物质量减少了0.31 g,则原混合物中碳酸钠的质量为
A. 3.38 g B. 4.16 g C. 4.58 g D. 4.41 g
【答案】B
【解析】采用差量法,即
2NaHCO3=Na2CO3+CO2↑+H2O △m↓
2×84 62g
0.84g 0.31g
所以原混合物中碳酸钠的质量为5.00g-0.84g=4.16g。答案选B。

【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
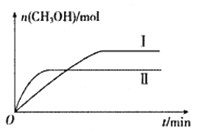
①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
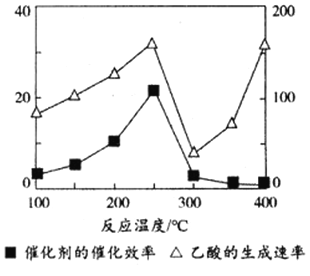
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。