题目内容
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
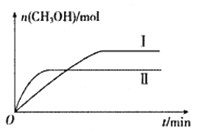
①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
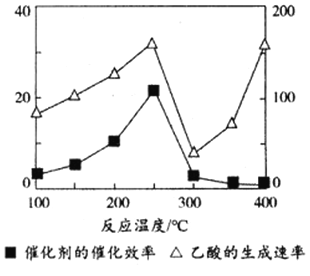
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。
【答案】 -159.47 高温 BD 否 > 12.5% 0.4<c<1 300~400℃
【解析】(1)①反应Ⅰ:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=a kJmol-1,反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2(s)+H2O(g)△H2=+72.49kJmol-1,总反应Ⅲ:2NH3(g)+CO2(g) =CO(NH2)2(s)+H2O(g)△H3=-86.98kJmol-1,由盖斯定律总反应Ⅲ-反应Ⅱ,得到2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=a=-159.47kJmol-1,故答案为:-159.47;
②反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2(s)+H2O(g)△H2=+72.49kJmol-1,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,故答案为:高温;
③A.反应I中反应物为气体,生成全部为固体,所以在反应前后,混合气体的平均相对分子质量保持不变,所以不能作为平衡状态的判断标志,故A错误;B.反应I中,气体的物质的量减小,所以反应的压强减小,所以容器内气体总压强不再变化时,说明反应处于平衡状态,故B正确;C.反应处于平衡状态时v正(NH3)=2v逆(CO2),故C错误;D.反应I中,容器体积不变,气体质量减小,所以当容器内混合气体的密度不再变化时,说明反应处于平衡状态,故D正确;故选BD;
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,发生NH2CO2NH4(s) ![]() CO(NH2)2(s)+H2O(g),水蒸气进入环境中,浓度近似为0,无论经过多长时间,反应都不会建立平衡状态,故答案为:否;
CO(NH2)2(s)+H2O(g),水蒸气进入环境中,浓度近似为0,无论经过多长时间,反应都不会建立平衡状态,故答案为:否;
(2)①II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,即II的温度大于I,温度越高,平衡向逆反应方向移动,导致化学平衡常数越小,所以KⅠ>KⅡ,,故答案为:>;
②设二氧化碳反应量为x
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始量(mol): 1 3 0 0
转化量(mol): x 3x x x
平衡量(mol):1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即![]() =0.8 ,解得x=0.4mol,甲容器平衡混合气体中CH3OH(g)的体积分数=物质的量分数=
=0.8 ,解得x=0.4mol,甲容器平衡混合气体中CH3OH(g)的体积分数=物质的量分数=![]() ×100%=12.5%;依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<c<1mol,故答案为:12.5%;0.4<c<1;
×100%=12.5%;依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<c<1mol,故答案为:12.5%;0.4<c<1;
(3)①温度超过250℃时,催化剂的催化效率降低,在300℃时失去活性,故以后乙酸的生成速率升高是由温度升高导致的,故乙酸主要取决于温度影响的范围为300℃~400℃,故答案为:300℃~400℃。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O2NH3+ ![]() O2 , 进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
O2 , 进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
T/℃ | 30 | 40 | 50 |
生成NH3量/(10﹣6 mol) | 4.8 | 5.9 | 6.0 |
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为molh﹣1 .
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是 . 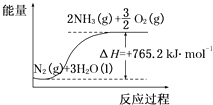
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议: .
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 在某压强恒定的密闭容器中加入2mol N2和4mol H2 , 达到平衡时,N2的转化率为50%,体积变为10L.求: ①该条件下的平衡常数为;
②若向该容器中加入a mol N2、b mol H2、c mol NH3 , 且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量(填“>”“<”或“=”)92.4kJ.