题目内容
【题目】根据价层电子对判断下列分子或者离子的空间构型是平面正三角形的是( )
A.NH3B.CF4C.H2SD.CO32-
【答案】D
【解析】
A.NH3分子中,价层电子对个数=σ键个数+孤电子对个数=3+![]() (5-1×3)=4,所以氮原子采取sp3杂化,故空间结构为三角锥形,A错误;
(5-1×3)=4,所以氮原子采取sp3杂化,故空间结构为三角锥形,A错误;
B.CF4中价层电子对个数=σ键个数+孤电子对个数=4+![]() (4-1×4)=4,所以碳原子采取sp3杂化,价层电子对模型为正四面体,B错误;
(4-1×4)=4,所以碳原子采取sp3杂化,价层电子对模型为正四面体,B错误;
C.H2S分子中,中心S原子成2个σ键、有2个孤对电子,价层电子对个数=2+![]() ×(6-1×2)=2,采取sp3杂化,空间结构为V型,C错误;
×(6-1×2)=2,采取sp3杂化,空间结构为V型,C错误;
D.CO32-中价层电子对个数=σ键个数+孤电子对个数=3+![]() (4+2-2×3)=3,所以碳原子采取sp2杂化,价层电子对模型为平面正三角形,D正确;
(4+2-2×3)=3,所以碳原子采取sp2杂化,价层电子对模型为平面正三角形,D正确;
答案选D。

【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5mL 0.5mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C-S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C-S-的电子式__________________________。
(2)用离子方程式表示FeSO4溶液显酸性的原因______________________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因___________。
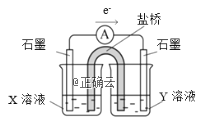
②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________________。