题目内容
相同温度下,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:2XY2(g)+Y2(g)?2XY3(g)△H=-Q kJ?mol-1(Q>0)实验测得反应在起始、达到平衡时的有关数据如下表所示:
下列叙述不正确的是( )
| 容器 编号 |
起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| XY2 | Y2 | XY3 | ||
| ① | 2 | 1 | 0 | 放热 0.25 Q kJ |
| ② | 1.2 | 0.6 | 0.8 | |
A、容器①、②中反应的平衡常数均为
| ||
| B、达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol?L-1 | ||
| C、容器②中反应达到平衡时放出的热量为0.15 Q kJ | ||
| D、若容器①的其他条件不变,恒压下通入稀有气体,则达到平衡时放出的热量小于0.25 Q kJ |
分析:A.容器①中参加反应的XY2的物质的量=2mol×
=0.5mol,利用三段式计算平衡时各物质的物质的量,进而计算平衡常数,容器①、②反应为完全等效平衡,对应组分的物质的量相等,据此判断②中发生的反应,若②中发生2XY2(g)+Y2(g)?2XY3(g),由于温度相等,平衡常数相等,若②中发生2XY3(g)?2XY2(g)+Y2(g),由于温度相等,平衡常数与①互为相反数;
B.容器①、②反应为完全等效平衡,平衡时Y2的物质的量浓度相等,结合A中计算判断;
C.结合A中计算分析②是否处于平衡状态或是向哪个方向进行,判断②是吸热还是放热,再根据转化率计算具体的值;
D.恒压下通入稀有气体,容器的容积增大,等效为降低压强,平衡向逆反应方向移动.
| 0.25QkJ |
| QkJ |
B.容器①、②反应为完全等效平衡,平衡时Y2的物质的量浓度相等,结合A中计算判断;
C.结合A中计算分析②是否处于平衡状态或是向哪个方向进行,判断②是吸热还是放热,再根据转化率计算具体的值;
D.恒压下通入稀有气体,容器的容积增大,等效为降低压强,平衡向逆反应方向移动.
解答:解:A.容器①参加反应的XY2的物质的量=2mol×
=0.5mol,则:
2XY2(g)+Y2(g)?2XY3(g)
起始(mol):2 1 0
转化(mol):0.5 0.25 0.5
平衡(mol):1.5 0.75 0.5
故①中平衡常数k=
=
,由②中各组分物质的量可知,②中反应向左建立平衡,其平衡常数k=13.5,故A错误;
B.容器①、②反应为完全等效平衡,平衡时Y2的物质的量浓度相等,结合A中计算可知,平衡时Y2的物质的量浓度=
=1.5mol/L,故B正确;
C.平衡时①容器中XY2、Y2、XY3的物质的量分别为1.5mol、0.75mol和0.5mol,②与①为完全等效平衡,所以,平衡时②容器中XY2、Y2、XY3的物质的量分别为1.5mol、0.75mol和0.5mol,可知②的反应向逆反应方向进行,反应过程需要吸收热,故C错误;
D.恒压下通入稀有气体,容器的容积增大,等效为降低压强,平衡向逆反应方向移动,反应物转化率降低,故放出的热量小于0.25 Q kJ,故D正确,
故选AC.
| 0.25QkJ |
| QkJ |
2XY2(g)+Y2(g)?2XY3(g)
起始(mol):2 1 0
转化(mol):0.5 0.25 0.5
平衡(mol):1.5 0.75 0.5
故①中平衡常数k=
(
| ||||
(
|
| 1 |
| 13.5 |
B.容器①、②反应为完全等效平衡,平衡时Y2的物质的量浓度相等,结合A中计算可知,平衡时Y2的物质的量浓度=
| 0.75mol |
| 0.5L |
C.平衡时①容器中XY2、Y2、XY3的物质的量分别为1.5mol、0.75mol和0.5mol,②与①为完全等效平衡,所以,平衡时②容器中XY2、Y2、XY3的物质的量分别为1.5mol、0.75mol和0.5mol,可知②的反应向逆反应方向进行,反应过程需要吸收热,故C错误;
D.恒压下通入稀有气体,容器的容积增大,等效为降低压强,平衡向逆反应方向移动,反应物转化率降低,故放出的热量小于0.25 Q kJ,故D正确,
故选AC.
点评:本题考查化学平衡移动问题、等效平衡、反应热等问题,题目难度中等,注意C项根据计算判断是吸热还是放热,注意等效平衡思想的应用,A选项为易错点,容易忽略反应建立平衡方向.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
| (2009?南通二模)相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应: N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
| ||||||||||||||||||
在相同温度下,体积均为1L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应.平衡时有关数据如下(已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1).
|
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g);△H=-92.6kJ?mol-1,实验测得反应起始时、达到平衡状态时的有关数据如下表所示,不正确的是( )
| ||||||||||||||||||
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ?mol-1起始时各物质物质的量如下表所示:
达到平衡后,①容器中XY3的物质的量为0.5mol.下列叙述正确的是( )
| 容器 编号 |
起始时各物质物质的量/mol | ||
| X2 | Y2 | XY3 | |
| ① | 1 | 3 | 0 |
| ② | 0.6 | 1.8 | 0.8 |
| A、容器①、②中反应的平衡常数不相等 |
| B、达平衡时,容器②中 XY3的物质的量浓度为2mol?L-1 |
| C、容器①中反应达到平衡时放出的热量为23.15kJ |
| D、容器②中反应达到平衡时放出热量 |
相同温度下,体积均为0.5L的两个恒容密闭容器中发生可逆反应:A(g)+2B(g)?xC(g)△H=-64kJ?mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示.下列叙述错误的是( )
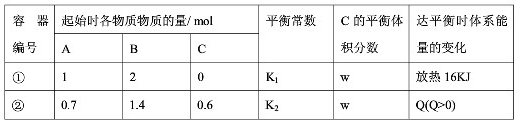

| A、x=2 | B、容器①、②中反应的平衡常数K1=K2 | C、若容器①体积为0.4L,则达平衡时放出的热量可能仍为16kJ | D、达平衡时,两个容器中C的物质的量浓度均为1mol.L-1 |