题目内容
【题目】下列说法正确的是
A. CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-801.3kJ·mol-1,结论:CH4 的燃烧热为△H=-801.3kJ·mol-1
B. 稀溶液中有 H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,结论:将盐酸与氨水的稀溶液混合后,若生成 1mol H2O,则会放出 57.3kJ 的能量
C. Sn(s,灰)![]() Sn(s,白) ΔH=+2.1kJ/mol (灰锡为粉末状),结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
Sn(s,白) ΔH=+2.1kJ/mol (灰锡为粉末状),结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
D. C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ/mol C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1,结论:相同条件下金刚石性质比石墨稳定
【答案】C
【解析】
A.1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热;
B.强酸和强碱的稀溶液完全发生中和反应生成1mol液态水时放出的热量叫中和热;
C.降低温度平衡向放热反应方向进行;
D.将题目所给两个方程式相减可得出石墨与金刚石的能量转化关系,物质所含能量越低越稳定。
A、1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,水为液态水时才是甲烷的燃烧热,故错误;
B、强酸和强碱的稀溶液完全发生中和反应生成1mol液态水时放出的热量叫中和热,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,氨水是弱碱,电离需要吸热,反应放出的热量小于57.3kJ,故错误;
C、降温平衡向放热反应方向移动,冬天温度低正反应吸热,平衡逆向移动转化为粉末状的灰锡而损坏,故正确;
D、C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1①;C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1②;①-②得C(s,石墨)=C(s,金刚石) ΔH=+1.5kJ/mol,说明石墨变成金刚石要吸收热量,即金刚石比石墨能量高,物质所含能量越低越稳定,所以石墨更稳定,故错误;
综上所述,本题选C。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】下列实验现象不能说明相应的化学反应一定是放热反应的是
选项 | A | B | C | D |
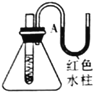
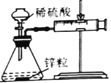
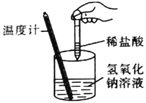
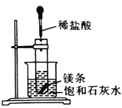
反应装置 |
|
|
|
|
实验现象 | 试管中生石灰和水混合后,A处红色水柱下降 | 反应开始后,针筒活塞向右移动 | 温度计的水银柱不断上升 | 饱和石灰水变浑浊 |
A. A B. B C. C D. D