题目内容
【题目】有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以 Fe3+离子的形式存在,则样品①的质量为_________g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量 (设为ag)范围是________。
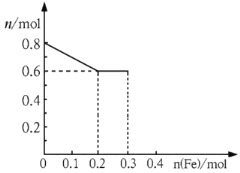
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3三种离子中的一种离子的物质的量的变化曲线如下图所示,则该曲线表示的是物质的量变化的曲线,请你在此图中再画出另外两种离子的物质的量的变化曲线。
【答案】
(1)11.2
(2)11.2<a<16.8 或 11.2g<ag<16.8g
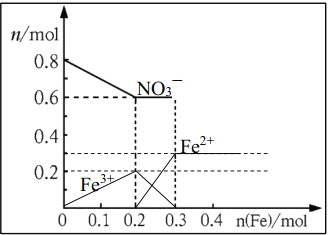
(3)NO3(1分)如下图
【解析】
试题分析:(1)设Fe的物质的量是x,则生成硝酸铁也是x,所以被还原的硝酸是0.8mol-3x,根据电子的得失守恒可知,3x=3×(0.8mol-3x),解得x=0.2mol,所以铁的质量是0.2mol×56g/mol=11.2g。
(2)如果铁的氧化产物是亚铁离子,则生成硝酸亚铁是2x,所以被还原的硝酸是0.8mol-2x,
根据电子的得失守恒可知,2x=3×(0.8mol-2x),解得x=0.3mol,所以铁的质量是0.3mol×56g/mol=16.8g,因此如果是反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量是11.2<a<16.8;
(3)由于最初溶液中NO3-的物质的量就是0.8mol,所以曲线表示的是NO3-的物质的量变化的曲线;根据反应的方程式Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、2Fe(NO3)3+Fe=3Fe(NO3)2可知,铁离子的最大值是0.2mol。如果继续加入铁,则开始生成亚铁离子,亚铁离子的最大值是0.3mol。