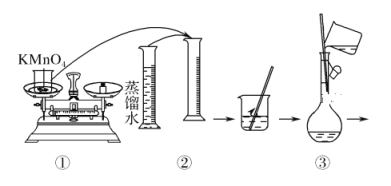
题目内容
【题目】为除去粗盐中的CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
![]()
(1) 判断BaCl2已过量的方法是_______________________________________________。
(2) 第⑥步中,相关的离子方程式是______________________,_____________________。
(3) 为检验精盐纯度,需配制230mL0.2mol/L NaCl(精盐)溶液,则需用托盘天平称取精盐固体的质量为_____,需要的玻璃仪器有量筒、 烧杯、玻璃棒、____________、 __________。
(4) 配制NaCl(精盐)溶液时,若出现下列操作,造成结果偏低的是__________
A.称量时NaCl已潮解 B.称取时砝码与物体放反了
C.定容摇匀时,液面下降又加水 D.定容时俯视刻度线
【答案】静置,向上层清液中继续滴加BaCl2溶液,若无浑浊出现,则证明BaCl2过量(合理即可) H++OH-=H2O 2H++CO32-=CO2+H2O 2.9g 250ml容量瓶 胶头滴管 A BC
【解析】
由题意知,把粗盐溶于水后,加入稍过量的氯化钡溶液除硫酸根,再加入过量的氢氧化钠溶液除去粗盐中的镁离子,再加入稍过量的碳酸钠溶液除去过量的钡离子和粗盐中的钙离子,过滤后,向滤液中加入适量的盐酸除去过量的氢氧化钠和碳酸钠后,蒸发、结晶、烘干得到精盐。
(1)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第②静置后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(2)由于加入的氢氧化钠和碳酸钠都是过量的,所以需要在步骤⑥加入适量盐酸除去,反应的离子方程式分别为:H++OH-=H2O、2H++CO32-=CO2+H2O;
(3)为检验精盐纯度,需配230mL 0.2mol/L NaCl(精盐)溶液,由于没有230mL的容量瓶,需选择250mL的容量瓶配制250mL溶液,并且按照250mL溶液计算出所需氯化钠的质量为0.25L×0.2mol/L×58.5g/mol=2.925g,则需用托盘天平称取精盐固体的质量为2.9g;需要的玻璃仪器有量筒、 烧杯、玻璃棒、250mL容量瓶、胶头滴管;
(4)配制NaCl(精盐)溶液时,若出现下列操作:
A.称量时NaCl已潮解,则称量氯化钠的质量偏小,所配溶液浓度偏低;
B. 称取时砝码与物体放反了,所称量溶质质量偏小,所配溶液浓度偏低;
C.定容、摇匀后,液面下降又加水,溶液体积偏大,所配溶液浓度偏低;
D.定容时俯视刻度线,溶液体积偏小,所配溶液浓度偏高;
其结果偏高的是ABC。

【题目】氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的主要流程如下:
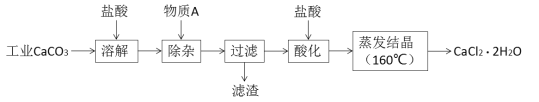
完成下列填空:
(1)除杂操作是加入物质A来调节溶液的pH,以除去溶液中的Al3+、Fe3+,根据下表所给信息,此时控制溶液的pH范围是_____________,加入的物质A是___________(写化学式)。
开始沉淀时的pH | 沉淀完全时的pH | 沉淀开始溶解时的pH | |
Al(OH)3 | 3.3 | 5.2 | 7.8 |
Fe(OH)3 | 1.5 | 4.1 | - |
(2)检验Fe3+是否沉淀完全的实验操作是____________________________________________。
(3)酸化操作是加入盐酸,调节溶液的pH,其目的是_________________________________。
(4)测定制得的样品的纯度,可采用如下方案:
a.称取0.750 g样品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.050 mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为__________________(保留三位有效数字)。
③若配制和滴定操作均无误,但最终测定的样品中CaCl2·2H2O的质量分数偏高,写出可能导致该结果的一种情况___________________________________________。