题目内容
【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,测定蛋壳中钙含量的操作步骤如图所示:
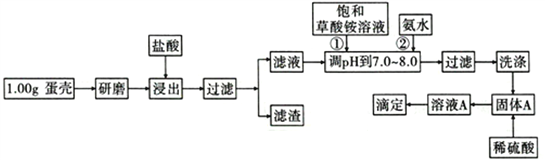
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________________________________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________________。
(3)洗涤最好选用_____(填“冰水”或“0. lmol/L草酸铵溶液”),其目的是____________________。
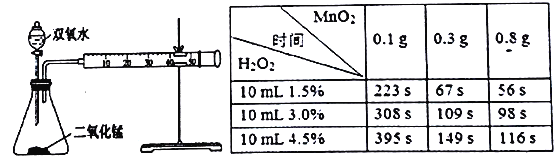
(4)在一定温度下,向2L的密闭容器中放入足量的草酸钙(固体所占体积忽略不计)发生反应: CaC204(s) ![]() CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
(5)滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。 步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化。
步骤3:用0.0190 mol·L-1KMnO4溶液滴定步骤2所得溶液至终点,消粍KMnO4溶液V1mL。
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol /L) | KMnO4液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2= 20.00 |
3 | 0.0190 | V3=19.98 |
4 | 0.0190 | V4 = 20.80 |
①KMnO4溶液和草酸溶液在稀硫酸中反应的离子方程式为____________________。
②滴定终点的现象是________________________________________。
③该蛋壳中CaCO3的质量分数=_______%,则此法求得的钙含量_________实际值(填“>”“=”或“<”)
【答案】 SiO2 保持较大的C2O42-浓度,使Ca2+沉淀完全(合理答案均可给分) 0.1mol/L草酸铵溶液 减少草酸钙固体的溶解 0.02 mol·L-1·min-1 2MnO4-+6H++5H2C2O4==2Mn2++10CO2↑+8H2O 当加入最后1滴高锰酸钾溶液时,溶液颜色由无色变成紫红色,且30S内不褪色 95.00 >
【解析】(1)样品中SiO2与盐酸不反应,所以得到的滤渣为SiO2。
(2)C2O42-+H+![]() HC2O4-,HC2O4-+H+
HC2O4-,HC2O4-+H+![]() H2C2O4,在碱性条件下,上述平衡逆向移动,C2O42-的浓度增大,有利于Ca2+沉淀完全,故答案为:保持较大的C2O42-浓度,使Ca2+沉淀完全。
H2C2O4,在碱性条件下,上述平衡逆向移动,C2O42-的浓度增大,有利于Ca2+沉淀完全,故答案为:保持较大的C2O42-浓度,使Ca2+沉淀完全。
(3)CaC2O4(s) ![]() Ca2+(aq)+C2O42-(aq),用0. 1mol/L草酸铵溶液洗涤,C2O42-浓度增大,可以使上述溶解平衡逆向移动,从而减少CaC2O4固体的溶解,答案为减少草酸钙固体的溶解。
Ca2+(aq)+C2O42-(aq),用0. 1mol/L草酸铵溶液洗涤,C2O42-浓度增大,可以使上述溶解平衡逆向移动,从而减少CaC2O4固体的溶解,答案为减少草酸钙固体的溶解。
(4)CaO的物质的量=11.2g/56g·mol-1=0.2mol,所以生成的CO的物质的量也为0.2mol,v(CO)=0.2mol÷2L÷5min=0.02 mol·L-1·min-1。
(5)①KMnO4具有强氧化性,草酸具有还原性,两者发生氧化还原反应,离子方程式为: 2MnO4-+6H++5H2C2O4==2Mn2++10CO2↑+8H2O 。 ②高锰酸钾溶液呈紫红色,加入到草酸溶液中时紫红色褪去,混合溶液显无色,当滴定完成时再滴入一滴高锰酸钾溶液,溶液将会由无色变成紫红色,且30s内不褪色,即可说明滴定已经达到终点,故答案为:当加入最后1滴高锰酸钾溶液时,溶液颜色由无色变成紫红色,且30S内不褪色。③第4次滴定时高锰酸钾溶液的体积与前3次的体积相差较大,说明第4次滴定误差较大,舍去这组数据,滴定时平均消耗的高锰酸钾溶液的体积为(20.02+20.00+19.98)÷3mL=20.00mL,所以消耗的高锰酸钾的物质的量为20.00×10-3L×0.0190 mol /L=3.8×10-4mol,根据2MnO4-+6H++5H2C2O4==2Mn2++10CO2↑+8H2O可知草酸的物质的量为2.5×3.8×10-4mol=9.5×10-4mol,故草酸钙的物质的量也为9.5×10-4mol,从而碳酸钙的物质的量也为9.5×10-4mol,求得碳酸钙的质量为9.5×10-4mol×100g/mol=9.5×10-2g,以上的数据都是根据25ml溶液A计算的,所以250ml溶液A中含有碳酸钙的质量为9.5×10-2g×10=0.95g,故CaCO3的质量分数=0.95g/1.0g×100%=95%;因为在生成草酸钙沉淀的同时也会生成草酸镁沉淀,导致得到的固体A中含有草酸镁,而使A溶液中草酸的量增大,消耗的高锰酸钾溶液的体积偏大,故此法求得的钙含量大于实际值。

【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,测定蛋壳中钙含量的操作步骤如图所示:
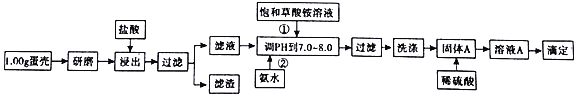
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是______________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_________。
(3)洗涤固体A最好选用“冰水”洗涤,其目的是___________。
(4)在一定温度下,向2L的密闭容器中放人足量的草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)![]() CaO(s)+CO(g)+CO2(g)若前5min内生成CaO的质量为l1.2g,则该段时间内v(CO)=_________。
CaO(s)+CO(g)+CO2(g)若前5min内生成CaO的质量为l1.2g,则该段时间内v(CO)=_________。
(5)用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。
步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化。
步骤3:用0.0190mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1mI。
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2=20.00 |
3 | 0.0190 | V3=19.98 |
4 | 0.0190 | V4=20.80 |
①滴定终点的现象是______________________。
②该蛋壳中CaCO3的质量分数=______%,则此法求得的钙含量_____实际值(填“>”“=”或“<”)。