题目内容
【题目】某温度下,在起始压强为80kPa的刚性容器中,发生NO的氧化反应:2NO(g)+O2(g)2NO2(g) △H,该反应的反应历程分两步进行,其速率方程和反应过程中能量变化如下:
①2NO(g)N2O2(g) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
②N2O2(g)+O2(g)2NO2(g) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
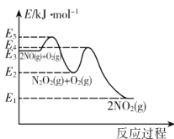
下列说法正确的是
A.NO氧化反应速率快慢的决定步骤的活化能是E5—E3
B.一定温度下,2NO(g)+O2(g)2NO2 (g)平衡常数表达式K=![]()
C.升高温度,NO氧化反应的化学平衡向逆反应方向移动
D.该温度下,将等物质的量的NO和O2混合反应(忽略2NO2N2O4),NO的平衡转化率为40%时,该反应的平衡常数Kp=![]() kPa-1
kPa-1
【答案】BC
【解析】
A.整体的反应速率取决于慢反应,活化能越大,反应速率越慢,据图可知活化能大的步骤为第二步反应,活化能为E4—E2,故A错误;
B.2NO(g)+O2(g)2NO2(g)平衡常数表达式K=![]() ,而对于反应①平衡时正逆反应速率相等,即k1正c2(NO)= k1逆c(N2O2),所以K1=
,而对于反应①平衡时正逆反应速率相等,即k1正c2(NO)= k1逆c(N2O2),所以K1=![]() =
=![]() ,同理可得反应②的平衡常数K2=
,同理可得反应②的平衡常数K2=![]() =
=![]() ,所以K=K1·K2=
,所以K=K1·K2=![]() ,故B正确;
,故B正确;
C.据图可知该反应的反应物能量高于生成物能量,所以为放热反应,升高温度,平衡逆向移动,故C正确;
D.设等物质的量的NO和O2分别为40mol,NO的平衡转化率为40%,列三段式有

刚性容器中气体的压强比等于物质的量之比,起始气体的总物质的量为80mol,压强为80kPa,则平衡时p(NO)=24kPa,p(O2)=32kPa,p(NO2)=16 kPa,Kp=![]() =
=![]() kPa-1,故D错误;
kPa-1,故D错误;
故答案为BC。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目