题目内容
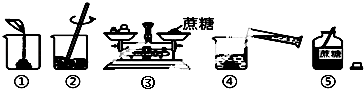
【题目】某同学做浓度对化学反应速率的影响的实验时,将3支试管分别编号为①②③,并按下表中物质的量进行实验,记录下的时间数据是16 s、28 s、33 s。请将3个数据填入下面的适当位置,并写出实验结论。

(1)将对应①、②、③的时间分别写出:
(a)________,(b)________,(c)________。
(2)实验结论:______________________________________________。
(3)写出反应的化学方程式:______________________________。
【答案】 33 s 28 s 16 s 反应物浓度越大,反应速率越快 Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
【解析】(1)图表中主要是改变了反应物的浓度,从而对反应速率产生了影响,浓度越大反应速率越大,反应物浓度①<②<③,则反应③速率最大,时间最短,反应①速率最小,时间最长,因此答案是33 s;28 s;16 s。
(2)对于一个化学反应,在其他条件不变时,改变反应物浓度,对反应速率的影响是:浓度越大反应速率越大。故答案是:反应物浓度越大,反应速率越快。
(3)Na2S2O3溶液和稀硫酸反应生成单质硫、二氧化硫和水,反应的化学方程式是:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。

练习册系列答案
相关题目