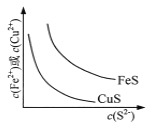
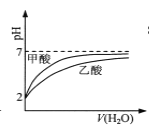
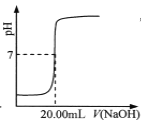
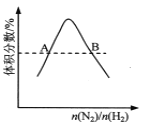
��Ŀ����
����Ŀ������N�����ף�P�����飨As���Ȣ�AԪ�ػ��������о�������������Ҫ��;�����ҹ�������Ա�о�����As2O3��д��As4O6���׳���˪����Ѫ�������Ե��������á��ش��������⣺
��1��Asԭ�ӵļĺ�������Ų�ʽΪ_____��P�ĵ�һ�����ܱ�S���ԭ��Ϊ________��
��2��д��һ����CN-��Ϊ�ȵ�����ķ���___���û�ѧʽ��ʾ����(SCN)2�����������ͦм�������Ϊ__��
��3����˪�綾������ʯ����������AsO33-����AsO43-������AsO33-��As���ӻ���ʽΪ___��AsO43-�Ŀռ乹��Ϊ___��
��4��NH4+��H-N-H���DZ�NH3��H-N-H�ļ��Ǵ��ԭ����____��NH3��ˮ������ͭ�����γɵĻ������������ӳ����������İ�����ṹ����ͼ���û��������ʱ����ʧȥˮ�����ԭ�ӽṹ�Ƕȼ���____��
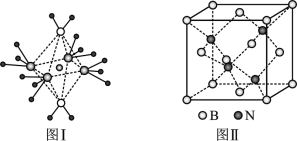
��5��BN���۵�Ϊ3000�棬�ܶ�Ϊ2.25g/cm3���侧���ṹ����ͼ����ʾ��������һ��Bԭ����Χ���������Nԭ����____������ԭ�Ӱ뾶�ֱ�ΪrN��rB�������ӵ�����ֵΪNA����BN������ԭ�ӵ����ռ��������İٷ���Ϊ_____��
���𰸡�1s22s22p63s23p63d104s24p3��[Ar]3d104s24p3 P��p�ܼ��ǰ����״̬���Ƚ��ȶ������Ե�һ�����ܱ���� CO��N2 5:4 sp3 �������� NH4+�ĵ�ԭ���Ͼ�Ϊ�ɼ����ӣ���NH3�����еĵ�ԭ������һ�Թ¶Ե��ӣ��¶Ե�����ɼ�����֮����ų���ǿ�ڳɼ�������ɼ�����֮����ų���������NH4+��H-N-H���DZ�NH3�д� ����Oԭ�Ӱ뾶С���縺�Դ��ṩ�¶Ե���������Nԭ��������ˮ�����γɵ���λ�����ڰ����� 4 ![]() ��100%
��100%
��������
��1��Asԭ�Ӻ�����33�����ӣ����ݹ���ԭ���жϺ�������Ų�������A��Ԫ�������p����ǰ����״̬������������Ԫ�ص�һ�����ܴ�
��2��CN-ԭ����Ϊ2���۵�����Ϊ10���ҵȵ���������������������SCN��2�ĽṹʽΪN![]() C��S��S��C
C��S��S��C![]() N�����ݽṹʽ������������������
N�����ݽṹʽ������������������
��3���ȼ���AsO33-��As�ϵŵ��Ӷ������ɼ����Ӷ����������ԭ������As�ļ۲���Ӷ���=�µ��Ӷ���+�ɼ����Ӷ�����Ȼ������ӻ���ʽ�Ϳռ乹�ͣ�
��4���¶Ե�����ɼ�����֮����ų���ǿ�ڳɼ�������ɼ�����֮����ų��������ǵ��¼��Ǵ�С��ԭ����ʱ����ʧȥˮ��˵��ˮ������Cu2+�γɵ���λ������NH3������Ȼ�����ˮ�����γɵ���λ�����ڰ�����ԭ�ɣ�
��5�����ݾ���ͼ�ж�һ��Nԭ����Χ���������Bԭ���ж��ٸ���������̯������Bԭ�Ӹ�����Nԭ�Ӹ�����Ȼ�����������ԭ�ӵ����ռ��������İٷֱȾ��ǿռ������ʡ�
��1��Asԭ�Ӻ�����33�����ӣ����ݹ���ԭ����Asԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s24p3��[Ar] 3d104s24p3��P��S�����ڵ������ڣ�S�ļ۵����Ų�ʽΪ3s23p4��P�ļ۵����Ų�ʽΪ3s23p3��P��3p�ܼ����ڰ�������Ƚ��ȶ���P�ĵ�һ�����ܱ�S�Ĵ𰸣�1s22s22p63s23p63d104s24p3��[Ar]3d104s24p3��P��p�ܼ��ǰ����״̬���Ƚ��ȶ������Ե�һ�����ܱ����
��2�����������������CN-��Ϊ�ȵ������������CO��N2��C22-�ȣ���SCN��2�ĽṹʽΪN![]() C��S��S��C
C��S��S��C![]() N������ȫ����������������1��������2����������SCN��2��������5��������4������������������������Ϊ5:4���𰸣�CO��N2��5:4��
N������ȫ����������������1��������2����������SCN��2��������5��������4������������������������Ϊ5:4���𰸣�CO��N2��5:4��
��3��AsO33-��As�ϵŵ��Ӷ���=![]() ��5+3-3
��5+3-3![]() 2��=1���ɼ����Ӷ���Ϊ3��As�ļ۲���Ӷ���Ϊ1+3=4��As���ӻ���ʽΪsp3�ӻ���AsO43-��As�ϵŵ��Ӷ���=
2��=1���ɼ����Ӷ���Ϊ3��As�ļ۲���Ӷ���Ϊ1+3=4��As���ӻ���ʽΪsp3�ӻ���AsO43-��As�ϵŵ��Ӷ���=![]() ��5+3-4
��5+3-4![]() 2��=0���ɼ����Ӷ���Ϊ4��As�ļ۲���Ӷ���Ϊ0+4=4��AsO43-��VSEPRģ��Ϊ�������壬����û�йµ��Ӷԣ�AsO43-�Ŀռ乹��Ϊ�������壻�𰸣� sp3���������壻
2��=0���ɼ����Ӷ���Ϊ4��As�ļ۲���Ӷ���Ϊ0+4=4��AsO43-��VSEPRģ��Ϊ�������壬����û�йµ��Ӷԣ�AsO43-�Ŀռ乹��Ϊ�������壻�𰸣� sp3���������壻
��4��NH4+��H��N��H�ļ��DZ�NH3��H��N��H
��5��������̯������B��8![]() +6
+6![]() =4��N��4���þ���Ļ�ѧʽΪBN�����ݾ�����������һ��Nԭ����Χ���������Bԭ����4������һ��Bԭ����Χ���������Nԭ����4����һ��������ԭ�ӵ����Ϊ4
=4��N��4���þ���Ļ�ѧʽΪBN�����ݾ�����������һ��Nԭ����Χ���������Bԭ����4������һ��Bԭ����Χ���������Nԭ����4����һ��������ԭ�ӵ����Ϊ4![]() ��
��![]() ��rN3+
��rN3+![]() ��rB3��pm3=4
��rB3��pm3=4![]() ��
��![]() ��rN3+
��rN3+![]() ��rB3��
��rB3��![]() 10-30cm3��1mol���������Ϊ25g��1mol��������Ϊ25g
10-30cm3��1mol���������Ϊ25g��1mol��������Ϊ25g![]() 2.25g/cm3�����������Ϊ4
2.25g/cm3�����������Ϊ4![]() ��25g
��25g![]() 2.25g/cm3
2.25g/cm3![]() NA����BN������ԭ�ӵ����ռ��������İٷ���Ϊ4
NA����BN������ԭ�ӵ����ռ��������İٷ���Ϊ4![]() ��
��![]() ��rN3+
��rN3+![]() ��rB3��
��rB3��![]() 10-30cm3
10-30cm3![]() [4
[4![]() ��25g
��25g![]() 2.25g/cm3
2.25g/cm3![]() NA��]=
NA��]=![]() ��100%���𰸣�
��100%���𰸣�![]() ��100%��
��100%��