题目内容
运用元素周期律分析下面的推断,其中错误的是
| A.砹(At)为有色固体,HAt不稳定 |
| B.铊(T1)是铝的同族元素,原子核外有6个电子层,推测T1(OH)3是两性氢氧化物 |
| C.已知锶Sr与镁同族且原子半径大于钙,硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)比硫化氢稳定性差 |
B
A正确,卤素单质从上到下,颜色逐渐加深;由于氢化物的稳定性与元素的非金属性有关,非金属性越强氢化物越稳定;
B错,铝为第IIIA族元素,同主族元素从上到下元素的金属性增强,T1(OH)3不可能是两性氢氧化物;
C正确,对于第IIA族元素的硫酸盐来说,如硫酸镁溶于水,硫酸钙微溶于水,硫酸钡难溶于水,可推测硫酸锶(SrSO4)是难溶于水的白色固体;
D正确,硒与硫为同主族元素,且硒位于硫的下方,非金属性比硫弱,氢化物的稳定性比硫弱;
B错,铝为第IIIA族元素,同主族元素从上到下元素的金属性增强,T1(OH)3不可能是两性氢氧化物;
C正确,对于第IIA族元素的硫酸盐来说,如硫酸镁溶于水,硫酸钙微溶于水,硫酸钡难溶于水,可推测硫酸锶(SrSO4)是难溶于水的白色固体;
D正确,硒与硫为同主族元素,且硒位于硫的下方,非金属性比硫弱,氢化物的稳定性比硫弱;

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
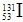 ),初步确认系来自日本核电站事故放射性物质的释放,但这些极微量的放射性物质对我国环境和公众健康不会产生影响,随后东部沿海地区也有类似发现。下列有关说法正确的是
),初步确认系来自日本核电站事故放射性物质的释放,但这些极微量的放射性物质对我国环境和公众健康不会产生影响,随后东部沿海地区也有类似发现。下列有关说法正确的是