题目内容
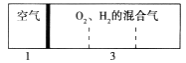
【题目】瓦斯中甲烷与氧气的体积比为1:2 时极易爆炸,此时甲烷与氧气的质量比为( )
A.1:1
B.1:2
C.1:3
D.1:4
【答案】D
【解析】解:瓦斯中甲烷与氧气的体积比为1:2 时极易爆炸,说明甲烷与氧气的物质的量之比为1:2,此时甲烷与氧气的质量比为1mol×16g/mol:2mol×32g/mol=1:4,故选D. 相同条件下,气体的体积之比等于其物质的量之比,再根据m=nM计算.

【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量的燃料完全燃烧时所放出的热量);
N2(g) + 2O2(g)= 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为_____________。
Ⅱ.脱碳:向2L密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l)。
CH3OH(l) + H2O(l)。
(1)①该反应自发进行的条件是___________(填“低温”“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是___________。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
e.1 mol CO2生成的同时有3 mol H—H键断裂
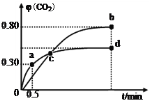
③CO2的浓度随时间(0~t2)的变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6的浓度随时间的变化。

(2)改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应II绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K( I ) __________K(II)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度c(I)___ ________c(II)。
②对反应I,前10 min内的平均反应速率v(CH3OH) =____________,在其他条件不变下,若30 min时只改变温度为T2℃,此时H2的物质的量为3.2 mol,则T1_________T2(填填“>”“<”或“=”)。若30 min时只向容器中再充入1 mol CO2(g)和1mol H2O(g),则平衡 ______________移动(填“正向”、“逆向”或“不”)。
【题目】下列有关原子结构的说法,正确的是 ( )
A. 稀有气体元素原子的最外层电子数都是8 B. 非金属元素的最外层电子数都大于3
C. 金属元素的最外层电子数都小于4 D. 氢原子的电子云是球形对称的
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
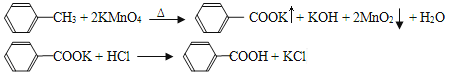
己知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g。
【制备产品】将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
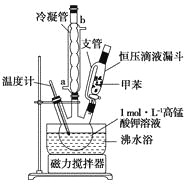
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。
(2)在本实验中,三领烧瓶最合适的容积___________(填字母)。
A.50mL | B.I00mL | C.200mL | D.250mL |
相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯
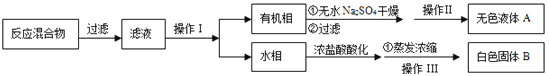
(3)操作Ⅰ的名称是 ;含有杂志的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是 。
(4)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体加入水中,加热溶解,______。 | 得到白色晶体和无色溶液 | |
② | 取少重滤液于试管中,________。 | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体,________。 | _____________________ | 白色晶体是苯甲酸 |
纯度测定:称取1.220g产品,配成100ml甲醇溶液,取25.00ml溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
第一次 | 第二次 | 第三次 | 第四 | |
体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果______________(填“偏大”、“偏小”或“不变”)。计算样品中苯甲酸纯度为______________。
【题目】碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)碳酸和草酸均为二元弱酸,其电离分为两步进行,已知其电离常数的有关数据如下表:向Na2CO3溶液中滴加草酸溶液,开始时所发生反应的离子方程式为 。
H2CO3 | H2C2O4 | |
K1 | 4.2×10-7 | 5.4×10-2 |
K2 | 5.6×10-11 | 5.4×10-5 |
(2)常温时,C和CO的燃烧热△H分别为-394.0 kJ·mol-1、-283.0 kJ·mol-1,该条件下C转化为CO的热化学方程式为 。
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下
2H2(g)+CO(g)![]() CH3OH(g) △H=Q kJ·mol-1。
CH3OH(g) △H=Q kJ·mol-1。
①该反应在不同温度下的化学平衡常数(K)如下表:
温度(℃) | 250 | 300 | 350 |
K(L2·mol-1) | 2.041 | 0.270 | 0.012 |
由此可判断Q 0(填“>”、“=”或“<”)
②一定温度下,将6 mol H2和2mol CO充入到体积为2 L的密闭容器中,10 min时反应达到平衡状态,此时测得c(CO)=0.2 mol·L-1,该温度下的平衡常数K= 。0~10 min内,反应速率v(CH3OH)= 。
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如下图所示:
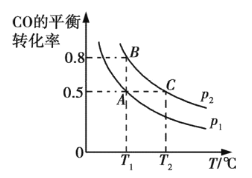
A、B两点压强大小关系:p1 p2(填“>”、“=”或“<”)。若A点对应容器的容积为20 L,则B点对应的容器的容积为 L。