题目内容
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量的燃料完全燃烧时所放出的热量);
N2(g) + 2O2(g)= 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为_____________。
Ⅱ.脱碳:向2L密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l)。
CH3OH(l) + H2O(l)。
(1)①该反应自发进行的条件是___________(填“低温”“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是___________。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
e.1 mol CO2生成的同时有3 mol H—H键断裂
③CO2的浓度随时间(0~t2)的变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6的浓度随时间的变化。

(2)改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应II绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K( I ) __________K(II)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度c(I)___ ________c(II)。
②对反应I,前10 min内的平均反应速率v(CH3OH) =____________,在其他条件不变下,若30 min时只改变温度为T2℃,此时H2的物质的量为3.2 mol,则T1_________T2(填填“>”“<”或“=”)。若30 min时只向容器中再充入1 mol CO2(g)和1mol H2O(g),则平衡 ______________移动(填“正向”、“逆向”或“不”)。
【答案】I.4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ/mol(2分)
II.(1)①低溫:(1分)②de;(2分)
③(2分)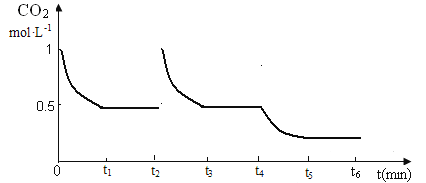
(2)①<;(1分)<;(1分)②0.025mol/L·min1);(2分)<;(1分)不(2分);
【解析】
试题分析:I.(1)根据氢气的热值可书写氢气的热化学方程式是2H2(g)+O2(g)=2H2O(l)△H=-142.9×4kJ·mol-1=-571.6kJ·mol-1,根据盖斯定律,将已知热化学方程式中的氧气与液态水消去得到H2还原NO2生成水蒸气和氮气的热化学方程式:4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=-1100.2kJ·mol-1;
Ⅱ.(1)①该反应的ΔS<0,所以若反应自发进行,则ΔH<0,因此反应在低温条件下自发进行;
②a.该体系中的气体只有二氧化碳和氢气,且二者的起始物质的量之比等于化学方程式中的化学计量数之比,所以是混合气体的平均式量始终保持不变,不能判断为平衡状态,a错误;b.CO2与H2始终是1:3的关系,所以CO2和H2的体积分数保持不变的状态不是平衡状态,b错误;c.CO2与H2的起始物质的量之比等于化学方程式中的化学计量数之比,所以二者的转化率一定相等,与是否达到平衡状态无关,c错误;d.因为该体系中有液体参加,所以气体的质量在逐渐减少,则气体的密度减小,达到平衡时,保持不变,d正确;e.1molCO2生成的同时有3molH-H键断裂,符合正逆反应速率相等,是平衡状态,e正确,答案选de;
③在t2时将容器容积缩小到原来的二分之一,CO2浓度瞬间增大到1mol·L-1,则压强增大,平衡正向移动,t3时达到平衡,达到的平衡与原平衡相同,浓度仍是0.5mol·L-1;该反应是放热反应,t4时降低温度,则平衡正向移动,t5时达到平衡,则二氧化碳的浓度将小于0.5mol·L-1,对应的图像见答案。
(2)①因为生成甲醇的反应是放热反应,而反应Ⅱ是从逆反应方向开始的,所以反应吸热,绝热容器的温度要低于恒温容器,即反应Ⅰ温度高于反应Ⅱ,温度升高,放热反应的平衡常数减小,则K(I)<K(II);二者都是恒容条件,若是恒温容器,二者达到的平衡是等效平衡,甲醇的浓度相同,而反应Ⅰ温度高于反应Ⅱ,所以反应Ⅱ需要再降低温度,而温度降低,平衡正向移动,则甲醇的浓度增大,平衡时CH3OH的浓度c(I)<c(II)。
②对于反应Ⅰ,前10min内氢气的物质的量减少6mol-4.5mol=1.5mol,则甲醇的物质的量增加0.5mol,所以前10min内平均反应速率v(CH3OH)= =0.025mol·L-1·min-1;30min时是平衡状态,生成甲醇1mol,则消耗氢气3mol,平衡时氢气的物质的量为3mol,而改变温度后氢气的物质的量变为3.2mol,物质的理增大,说明平衡逆向移动,因为该反应是放热反应,所以升高温度,平衡逆向移动,则T1<T2;若30min时只向容器中再充入1molCO2(g)和1molH2O(g),根据表中数据计算该温度下的平衡常数为K=
=0.025mol·L-1·min-1;30min时是平衡状态,生成甲醇1mol,则消耗氢气3mol,平衡时氢气的物质的量为3mol,而改变温度后氢气的物质的量变为3.2mol,物质的理增大,说明平衡逆向移动,因为该反应是放热反应,所以升高温度,平衡逆向移动,则T1<T2;若30min时只向容器中再充入1molCO2(g)和1molH2O(g),根据表中数据计算该温度下的平衡常数为K=![]() ,此时Qc=
,此时Qc= ![]() =K,所以平衡不移动。
=K,所以平衡不移动。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案【题目】仅依据下表给出的物理量X和Y,其中不能求出物质的量的是
A | B | C | D | |
X | 物质中的粒子数 | 标准状况下的 气体摩尔体积 | 固体的体积 | 溶液中溶质的 物质的量浓度 |
Y | 阿伏加德罗常数 | 标准状况下的 气体的体积 | 固体的密度 | 溶液体积 |
【题目】
(1)“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

①实验室在配制稀硫酸溶液时,下列操作可造成配制结果偏高的是________________。
A.采用仰视的方式量取浓硫酸 |
B.容量瓶在使用前未干燥,里面有少量蒸馏水 |
C.定容时,俯视容量瓶刻度线 |
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度 |
②“服用维生素C,可防止二价亚铁离子被氧化”,由此可见维生素C具有_________性。
③加入KSCN溶液后,在未加新制氯水前,溶液中也产生红色,其可能的原因是 。
④加入氯水后发生的反应的离子方程式为 、 。
⑤在实验中发现放置一段时间,溶液的颜色会逐渐褪去。请你对溶液褪色的原因作出3种猜想。
编号 | 猜 想 |
甲 | |
乙 | |
丙 |
(2)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O 为片剂。