题目内容
在25℃时取pH=x(x≤6)的盐酸溶液,VxL和pH=y(y≥8)的氢氧化钠溶液VyL,恰好中和。

(填>、<、=)。

(填>、<、=)。
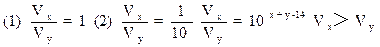
根据强酸溶液[H+]与强碱溶液[OH-]浓度关系与强酸溶液的pH酸与强碱溶液的pH碱之和之间存在如下规律:
当pH酸+pH碱=14时,则该强酸溶液的[H+]浓度跟强酸溶液的[OH-]浓度相等。
当pH酸+pH碱>14时,则该强碱溶液的[OH-]浓度大于强酸溶液的[H+]浓度,如当pH酸+pH碱=15,则强碱溶液的[OH-]浓度比强酸溶液的[H+]浓度大10倍。
当pH酸+pH碱<14时,则该强酸溶液的[H+]浓度大于强碱溶液的[OH-]浓度,如pH酸+pH碱=13,则强酸溶液[H+]浓度比强碱溶液的[OH-]大10倍。
可见若x+y=14,即盐酸的[H+]与氢氧化钠溶液的[OH-]浓度相等,完
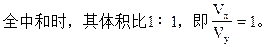
若x+y=13,即盐酸的[H+]的浓度比氢氧化钠溶液中[OH-]浓度大10
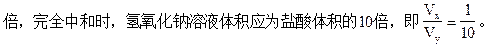
若x+y>14,氢氧化钠溶液的[OH-]浓度大于盐酸中[H+]的浓度,∴Vx>Vy。
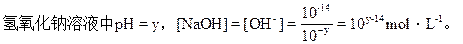
盐酸中pH=x,[H+]=10-x
恰好完全中和时,10-x×Vx=10y-14×Vy
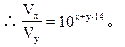
当pH酸+pH碱=14时,则该强酸溶液的[H+]浓度跟强酸溶液的[OH-]浓度相等。
当pH酸+pH碱>14时,则该强碱溶液的[OH-]浓度大于强酸溶液的[H+]浓度,如当pH酸+pH碱=15,则强碱溶液的[OH-]浓度比强酸溶液的[H+]浓度大10倍。
当pH酸+pH碱<14时,则该强酸溶液的[H+]浓度大于强碱溶液的[OH-]浓度,如pH酸+pH碱=13,则强酸溶液[H+]浓度比强碱溶液的[OH-]大10倍。
可见若x+y=14,即盐酸的[H+]与氢氧化钠溶液的[OH-]浓度相等,完
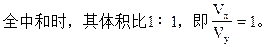
若x+y=13,即盐酸的[H+]的浓度比氢氧化钠溶液中[OH-]浓度大10
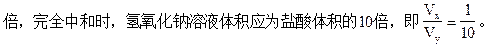
若x+y>14,氢氧化钠溶液的[OH-]浓度大于盐酸中[H+]的浓度,∴Vx>Vy。
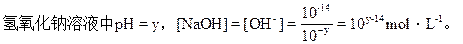
盐酸中pH=x,[H+]=10-x
恰好完全中和时,10-x×Vx=10y-14×Vy
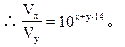

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目

