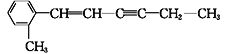��Ŀ����
����Ŀ��������ĿǰӦ����㷺�Ľ������ϣ��˽������ʴ��ԭ�����������������Ҫ���壬�Ը�����Ʒ���п���ʴ���������ʵ��ӳ���ʹ��������
��1������ʴ����ǰ�������г��������������⡣�ֽ�һ����������������������У��������������Һ�з����Ļ��Ϸ�Ӧ�Ļ�ѧ����ʽΪ��________________________��
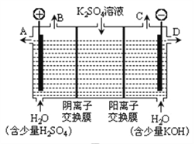
��2������ͼװ�ã�����ģ�����ĵ绯ѧ������

����XΪ̼����Ϊ���������ĸ�ʴ������KӦ����________����
����XΪп������K����M�����õ绯ѧ��������Ϊ________��
��3����ͼ����XΪ��ͭ�������к�ˮ�滻Ϊ����ͭ��Һ������K����N����һ��ʱ���������������3.2 gʱ��X�缫�ܽ��ͭ������________3.2 g(�<����>������)�����������ͭ����Ч��ֹ������ʴ�������������δ����ͭ����Ʋ����𣬶�ͭ���ȶ�п���������ױ���ʴ�����Ҫ˵��ԭ��_________________________________________________��
���𰸡�2FeCl3��Fe===3FeCl2 N ��������������������(����������������) < �ڳ�ʪ�Ļ����й���ԭ��أ����Ǹ��������ٸ�ʴ
��������
��1���������������Һ�з����ķ�Ӧ���������ᷴӦ�����Ȼ������������������Ȼ�����Ӧ�����Ȼ�������
��2������������̼�Ͻ𣬿���K�Ͽ�ʱ��������������̼����ˮ����ԭ��أ���Ҫ����������ʴ����XΪ̼��������K����M����������̼������ˮ����ԭ��أ�����Ϊ��������ʴ��������K����N����������̼������ˮ���ɵ��أ�����Ϊ������������
����XΪп������K����M������������п������ˮ����ԭ��أ�пΪ��������ʴ��������������
��3����ͼ����XΪ��ͭ����п�����ʣ��������к�ˮ�滻Ϊ����ͭ��Һ������K����N�������ɵ��أ���ͭ��ͭ��п����ʧ�������������ӣ������缫ֻ��ͭ���ӵõ������ɵ���ͭ���ڳ�ʪ�Ļ����У���ͭ���Ʋ�����ԭ��أ�������������ʴ����п���Ʋ�����ԭ��أ�п����������ʴ������������������
��1���������������Һ�з����ķ�Ӧ���������ᷴӦ�����Ȼ������������������Ȼ�����Ӧ�����Ȼ����������ڻ��Ϸ�Ӧ�ķ���ʽ��2FeCl3��Fe=3FeCl2���ʴ�Ϊ��2FeCl3��Fe=3FeCl2��
��2������������̼�Ͻ𣬿���K�Ͽ�ʱ������������̼����ˮ����ԭ��أ���Ҫ����������ʴ����XΪ̼��������K����M����������̼������ˮ����ԭ��أ�����Ϊ��������ʴ��������K����N����������̼������ˮ���ɵ��أ�����Ϊ����������������Ϊ���������ĸ�ʴ������KӦ����N�����ʴ�Ϊ��N��
����XΪп������K����M������������п������ˮ����ԭ��أ�пΪ��������ʴ���������������õ绯ѧ��������Ϊ��������������������(����������������)���ʴ�Ϊ����������������������(����������������)��
��3����ͼ����XΪ��ͭ����п�����ʣ��������к�ˮ�滻Ϊ����ͭ��Һ������K����N�������ɵ��أ�X�缫ͭ��п��ʧ�������������ӣ������缫ֻ��ͭ���ӵõ������ɵ���ͭ�����ݵ����غ㣬��������������3.2gʱ��X�缫�ܽ��ͭ������<3.2 g���ڳ�ʪ�Ļ����ж�ͭ���Ʋ�����ԭ��أ�������������ʴ����п���Ʋ�����ԭ��أ�п����������ʴ�������������������ʴ�Ϊ��<���ڳ�ʪ�Ļ����й���ԭ��أ����Ǹ��������ٸ�ʴ��