题目内容
【题目】工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:___Cr2O72-+__Fe2++__H+—__Cr3++__Fe3++__H2O。现有0.12g工业甲醇,在H2SO4溶液中与25mL0.2mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1mol·L-1FeSO4与其反应,结果用去FeSO4溶液9.6mL。
(1)配平第②步的离子方程式___。
(2)计算工业甲醇的质量分数___。
(3)工业上通常利用SiO2和碳反应来制取硅,写出反应的化学方程式__。
工业上还可以利用镁制取硅,反应为2Mg+SiO2=2MgO+Si,同时会发生副反应:2Mg+Si=Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
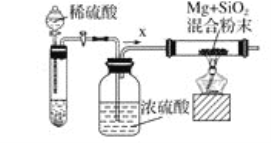
(4)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用__(填序号)。
A.石灰石 B.锌粒 C.纯碱
(5)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是__;当反应引发后,移走酒精灯,反应能继续进行,其原因是__。
(6)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃。用化学方程式表示这两个反应①___,②___。
【答案】1 6 14 2 6 7 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 90.7% SiO2+2C![]() Si+2CO↑ B 防止加热条件下H2与空气混合爆炸 Mg与SiO2的反应是放热反应 Mg2Si+4HCl=2MgCl2+SiH4↑ SiH4+2O2=SiO2+2H2O
Si+2CO↑ B 防止加热条件下H2与空气混合爆炸 Mg与SiO2的反应是放热反应 Mg2Si+4HCl=2MgCl2+SiH4↑ SiH4+2O2=SiO2+2H2O
【解析】
(1)依据氧化还原反应的元素化合价变化结合电子守恒计算配平离子方程式,电子转移:Cr2O72-~2Cr3+~6e-;6Fe2+~6Fe3+~6e-;所以根据电子守恒,结合电荷守恒和原子守恒得到配平的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)由反应②可知,反应①剩余的n(Cr2O72-)=n(Fe2+)÷6=9.6×10-3L× 1mol·L-1÷6 =0.0016 mol,反应①消耗的n(Cr2O72-)=25×10-3L× 0.2mol·L-1-0.0016mol= 0.0050 mol-0.0016 mol=0.0034 mol,则:n(CH3OH)=0.0034 mol,ω(CH3OH)=![]() ×100%=90.7%;
×100%=90.7%;
(3)工业上通常利用SiO2和碳反应来制取硅,同时生成CO,反应的化学方程式SiO2+2C![]() Si+2CO↑。
Si+2CO↑。
(4)Mg可以与CO2反应生成氧化镁和碳,Mg与氢气不能反应,因此可用氢气作为保护气,选用的药品为稀硫酸和锌粒,再用浓硫酸干燥,所以试管中的固体药品可选用锌粒,故选B;
(5)装置中有空气,若不用氢气排空装置中的空气,氢气和空气的混合气体加热会发生爆炸,所以反应开始前应该先通氢气排尽装置中的空气;
Mg与SiO2反应的条件是加热,停止加热后,反应能继续进行,其原因是:Mg与SiO2反应放出的热量维持反应的进行;
(6)Mg2Si遇盐酸迅速反应生成SiH4(硅烷),其反应的方程式为:Mg2Si+4HCl═2MgCl2+SiH4↑,SiH4常温下是一种不稳定、易自燃的气体,SiH4自燃的方程式为SiH4+2O2═SiO2+2H2O,所以往反应后的混合物中加入稀盐酸,可观察到闪亮的火星。

 阅读快车系列答案
阅读快车系列答案