题目内容
【题目】工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(1)已知CO(g)、H2(g)的标准燃烧热分别为-285.8kJmol-1,-283.0kJmol-1,且CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) △H=-761 kJmol-1;则CO(g)+ 2H2(g)
CO2(g)+2H2O(l) △H=-761 kJmol-1;则CO(g)+ 2H2(g)![]() CH3OH(g)的△H= ___________。
CH3OH(g)的△H= ___________。
(2)反应的ΔS_______0(填“>”、“<”或“=”)。在________(填“较高”或“较低”)温度下该反应自发进行。
(3)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是_______________。
A.容器内气体密度保持不变 B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与生成H2的速率相等 D.CO的体积分数保持不变
(4)下图中能正确反映平衡常数K随温度变化关系的曲线为__________(用a或b表示)。

(5)投料比n(H2)/n(CO)=2时,体系中CO的平衡转化率(α)温度和压强的关系如图2所示。α(CO)值随温度升高而___________(填“增大”或“减小”)其原因是___________________________;下图中的压强由大到小为__________________(用P1,P2,P3表示)。

(6)520K时, 投料比n(H2)/n(CO)=2(总物质的量为3mol),维持反应过程中压强P3不变,达到平衡时测得容器体积为0.1L,则平衡常数K=_______。若H2和CO的物质的量之比为n∶1(维持反应过程中压强P3不变),相应平衡体系中CH3OH的物质的量分数为x,请在下图中绘制x随n变化的示意图_______。

【答案】-90.8 < 较低 BD a 减小 升高温度时,反应为放热反应,平衡向左移动,使得体系中CO的量增大,使CO得转化率降低 P3>P2>P1 0.25 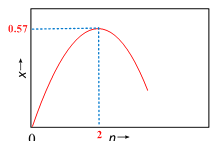
【解析】
(1)根据盖斯定律解答。
(2)根据CO(g)+ 2H2(g)![]() CH3OH(g)可知,气体分子数减少,ΔS<0,根据ΔG=△H-TΔS可知,温度较低时,ΔG可能小于0,即反应可以自发。
CH3OH(g)可知,气体分子数减少,ΔS<0,根据ΔG=△H-TΔS可知,温度较低时,ΔG可能小于0,即反应可以自发。
(3)反应达到平衡状态的标志:正反应速率等于逆反应速率;各成分的浓度保持不变。
(4)正反应为放热反应,升温,平衡向逆反应方向移动,平衡常数减小。
(5)正反应为放热反应,升温,平衡向逆反应方向移动,平衡体系中CO的量增大,所以随温度升高,CO的转化率减小;正反应是气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高。
(6)根据K= c(CH3OH)/c(CO)c2(H2)求算。
(1)CO燃烧的热化学方程式:CO(g)+1/2 O2(g)= CO2(g) △H=-285.8kJmol-1①,H2燃烧的热化学方程式:2H2(g)+ O2(g)= 2H2O(l) △H=-283.0×2 kJmol-1②,CH3OH燃烧的热化学方程式:CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) △H=-761 kJmol-1③,根据盖斯定律将①+②-③,可得CO(g)+ 2H2(g)
CO2(g)+2H2O(l) △H=-761 kJmol-1③,根据盖斯定律将①+②-③,可得CO(g)+ 2H2(g)![]() CH3OH(g)△H=-90.8 kJmol-1,故答案为:-90.8。
CH3OH(g)△H=-90.8 kJmol-1,故答案为:-90.8。
(2)根据CO(g)+ 2H2(g)![]() CH3OH(g)可知,气体分子数减少,ΔS<0,根据ΔG=△H-TΔS可知,温度较低时,ΔG可能小于0,即反应可以自发,故答案为:< ;较低。
CH3OH(g)可知,气体分子数减少,ΔS<0,根据ΔG=△H-TΔS可知,温度较低时,ΔG可能小于0,即反应可以自发,故答案为:< ;较低。
(3)A.反应前后质量和体积一直不变,所以密度一直不变,故A错误;
B. 反应前后质量不变,但物质的量在变,所以平均相对分子质量保持不变,说明反应达到平衡状态,故B正确;
C. 生成CH3OH的速率与生成H2的速率等于系数之比,才能证明正逆反应速率相等,此时给定的条件不能判断平衡,故C错误;
D.CO的体积分数保持不变,说明正逆反应速率相等,则反应达到平衡状态,故D正确。
故选BD。
(4)CO(g)+ 2H2(g)![]() CH3OH(g) △H=-90.8 kJmol-1,K=c(CH3OH)/c(CO)c2(H2),正反应为放热反应,升温,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,故答案为:a。
CH3OH(g) △H=-90.8 kJmol-1,K=c(CH3OH)/c(CO)c2(H2),正反应为放热反应,升温,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,故答案为:a。
(5)由图可知,压强一定时,随温度的升高, CO的转化率减小, CO(g)+ 2H2(g)![]() CH3OH(g) △H=-90.8 kJmol-1,正反应为放热反应,升温,平衡向逆反应方向移动,平衡体系中CO的量增大,所以随温度升高,CO的转化率减小;正反应是气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高,故压强为:P3>P2>P1,故答案为:减小;反应为放热反应,平衡向左移动,使得体系中CO的量增大,使CO得转化率降低 ;P3>P2>P1。
CH3OH(g) △H=-90.8 kJmol-1,正反应为放热反应,升温,平衡向逆反应方向移动,平衡体系中CO的量增大,所以随温度升高,CO的转化率减小;正反应是气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高,故压强为:P3>P2>P1,故答案为:减小;反应为放热反应,平衡向左移动,使得体系中CO的量增大,使CO得转化率降低 ;P3>P2>P1。
(6) CO(g)+ 2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol) 1 2 0
转化(mol) 0.8 1.6 0.8
平衡(mol) 0.2 0.4 0.8
容器体积为0.1L,平衡时CO的浓度为2mol/L,H2的浓度为4 mol/L,CH3OH的浓度为8 mol/L,K= c(CH3OH)/c(CO)c2(H2)=8/2×42=0.25。x随n变化的示意图:

故答案为:0.25; 。
。

 名校课堂系列答案
名校课堂系列答案【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。

(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:1.饱和NaClO溶液pH为1l;2.25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HCO:K=3×10-8
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称_______,装置A中发生反应的离子方程式_____。
②C瓶溶液中的溶质是NaCl、______(填化学式)。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因_______。
(2)测定C瓶溶液中NaClO含量(单位:g)的实验步骤如下:
Ⅰ.取C瓶溶液20ml于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00ml。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为______。
②通常选用______作指示剂,滴定至终点的现象______。
③C瓶溶液中NaClO含量为_______g/L(保留2位小数)









