题目内容
碱式碳酸铜是孔雀石的主要成分,加热时可分解为氧化铜、二氧化碳和水三种氧化物.
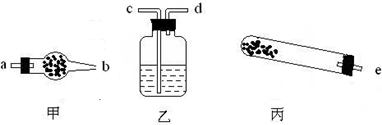
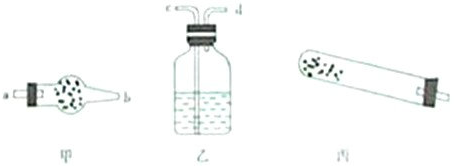
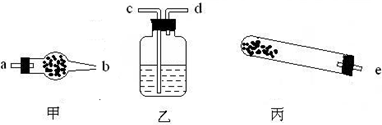
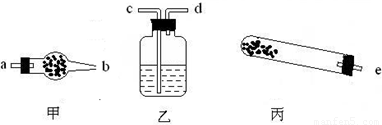
(1)若用下列仪器对分解产物中的非固体氧化物进行验证,仪器接口顺序是______(填字母).

按仪器连接顺序将仪器名称和对应仪器所装药品的名称填入下表.
| 仪器 | 试管 | ______ | ______ |
| 药品 | 碱式碳酸铜 | ______ | ______ |
(2)待(1)加热分解完全的试管冷却后,加入盐酸充分反应,CuO部分溶解,过滤:
①所得滤液中各种离子的物质的量浓度由大到小的顺序是______.
②将滤渣洗涤干燥,置于酒精蒸汽中并加热,黑色粉状固体逐渐变成红色固体,同时产生一种在常温下有刺激性气味的液体,该反应的化学方程式是______.
(3)将碱式碳酸铜与过量的木炭混合加热,也能得到(2)②所得的红色固体,该反应的化学方程式是______.
(4)铜及其合金用途广泛,常见的铜的合金有黄铜(铜锌合金)、青铜(铜锡合金)等.现有 w g黄铜样品,放入足量的稀盐酸中,产生V mL气体(标准状况下),则样品中铜和锌的物质的量之比是______(用含w、V的代数式表示).
解:(1)实验仪器的连接顺序为:反应装置→检验装置,所以先选e;生成物中有水和二氧化碳,因溶液中有水,为防止溶液中水的干扰,所以先检验水,后检验二氧化碳,所以仪器的连接顺序是e→a→b→c→d;检验水用无水硫酸铜,无水硫酸铜为固体,所以放在干燥管中;检验二氧化碳用澄清的石灰水,所以用洗气瓶;该反应需要加热,所以还需要酒精灯.
故答案为:e→a→b→c→d;干燥管→无水硫酸铜;洗气瓶→澄清石灰水;酒精灯.
(2)①氯化铜中氯离子与铜离子的比为2:1,且氯化铜是强酸弱碱盐能发生水解,铜离子发生水解,导致溶液中氢离子的浓度大于氢氧根离子的浓度,所以滤液中各种离子的物质的量浓度由大到小的顺序是c(Cl-)>c(Cu2+)>c(H+)>c(OH-).
故答案为:c(Cl-)>c(Cu2+)>c(H+)>c(OH-).
②滤渣为氧化铜,氧化铜能和酒精反应生成铜、乙醛和水,所以反应方程式为CuO+CH3CH2OH CH3CHO+Cu+H2O.
CH3CHO+Cu+H2O.
故答案为:CuO+CH3CH2OH CH3CHO+Cu+H2O.
CH3CHO+Cu+H2O.
(3)根据(2)②知,红色物质是铜,该反应发生氧化还原反应,碳被氧化物二氧化碳,碱式碳酸铜被还原为铜,同时有水生成,所以反应方程式为Cu2(OH)2CO3+C 2Cu+2CO2↑+H2O.
2Cu+2CO2↑+H2O.
故答案为:Cu2(OH)2CO3+C 2Cu+2CO2↑+H2O.
2Cu+2CO2↑+H2O.
(4)设生成V mL气体需要锌的质量为xg.
Zn+2HCl=ZnCl2+H2↑
65g 22.4L
xg 10-3V L
所以x=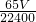
锌的物质的量为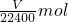
铜的质量为w g-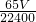 g=
g=
铜的物质的量为
则样品中铜和锌的物质的量之比是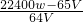 .
.
故答案为: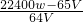 .
.
分析:(1)根据实验的发生装置、检验装置排序;根据检验的物质选择药品;根据反应条件选择仪器;
(2)①根据盐类的性质判断离子浓度的大小;
②根据氧化铜和酒精的反应写出反应方程式;
(3)根据反应物、生成物、反应条件写出反应方程式;
(4)根据锌与氢气的关系式计算锌的质量,总质量减去锌的质量就是铜的质量,然后求出两物质的物质的量之比.
点评:本题考查了铜及其化合物的性质,要注意的是写有机方程式时不能写等号;检验二氧化碳和水,需要先检验水再检验二氧化碳,检验水用无水硫酸铜;催化剂实际参加反应,只是经过一系列的反应后又生成原来的物质,表面看没参加反应.
故答案为:e→a→b→c→d;干燥管→无水硫酸铜;洗气瓶→澄清石灰水;酒精灯.
(2)①氯化铜中氯离子与铜离子的比为2:1,且氯化铜是强酸弱碱盐能发生水解,铜离子发生水解,导致溶液中氢离子的浓度大于氢氧根离子的浓度,所以滤液中各种离子的物质的量浓度由大到小的顺序是c(Cl-)>c(Cu2+)>c(H+)>c(OH-).
故答案为:c(Cl-)>c(Cu2+)>c(H+)>c(OH-).
②滤渣为氧化铜,氧化铜能和酒精反应生成铜、乙醛和水,所以反应方程式为CuO+CH3CH2OH
 CH3CHO+Cu+H2O.
CH3CHO+Cu+H2O.故答案为:CuO+CH3CH2OH
 CH3CHO+Cu+H2O.
CH3CHO+Cu+H2O.(3)根据(2)②知,红色物质是铜,该反应发生氧化还原反应,碳被氧化物二氧化碳,碱式碳酸铜被还原为铜,同时有水生成,所以反应方程式为Cu2(OH)2CO3+C
 2Cu+2CO2↑+H2O.
2Cu+2CO2↑+H2O.故答案为:Cu2(OH)2CO3+C
 2Cu+2CO2↑+H2O.
2Cu+2CO2↑+H2O.(4)设生成V mL气体需要锌的质量为xg.
Zn+2HCl=ZnCl2+H2↑
65g 22.4L
xg 10-3V L
所以x=
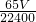
锌的物质的量为
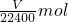
铜的质量为w g-
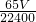 g=
g=
铜的物质的量为

则样品中铜和锌的物质的量之比是
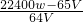 .
.故答案为:
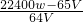 .
.分析:(1)根据实验的发生装置、检验装置排序;根据检验的物质选择药品;根据反应条件选择仪器;
(2)①根据盐类的性质判断离子浓度的大小;
②根据氧化铜和酒精的反应写出反应方程式;
(3)根据反应物、生成物、反应条件写出反应方程式;
(4)根据锌与氢气的关系式计算锌的质量,总质量减去锌的质量就是铜的质量,然后求出两物质的物质的量之比.
点评:本题考查了铜及其化合物的性质,要注意的是写有机方程式时不能写等号;检验二氧化碳和水,需要先检验水再检验二氧化碳,检验水用无水硫酸铜;催化剂实际参加反应,只是经过一系列的反应后又生成原来的物质,表面看没参加反应.

练习册系列答案
相关题目
碱式碳酸铜是孔雀石的主要成分,加热时可分解为氧化铜、二氧化碳和水三种氧化物.
(1)若用下列仪器对分解产物中的非固体氧化物进行验证,仪器接口顺序是 (填字母).
按仪器连接顺序将仪器名称和对应仪器所装药品的名称填入下表.
还需使用的玻璃仪器是 .
(2)待(1)加热分解完全的试管冷却后,加入盐酸充分反应,CuO部分溶解,过滤:
①所得滤液中各种离子的物质的量浓度由大到小的顺序是 .
②将滤渣洗涤干燥,置于酒精蒸汽中并加热,黑色粉状固体逐渐变成红色固体,同时产生一种在常温下有刺激性气味的液体,该反应的化学方程式是 .
(3)将碱式碳酸铜与过量的木炭混合加热,也能得到(2)②所得的红色固体,该反应的化学方程式是 .
(4)铜及其合金用途广泛,常见的铜的合金有黄铜(铜锌合金)、青铜(铜锡合金)等.现有 w g黄铜样品,放入足量的稀盐酸中,产生V mL气体(标准状况下),则样品中铜和锌的物质的量之比是 (用含w、V的代数式表示).
(1)若用下列仪器对分解产物中的非固体氧化物进行验证,仪器接口顺序是 (填字母).

按仪器连接顺序将仪器名称和对应仪器所装药品的名称填入下表.
| 仪器 | 试管 | ||
| 药品 | 碱式碳酸铜 |
(2)待(1)加热分解完全的试管冷却后,加入盐酸充分反应,CuO部分溶解,过滤:
①所得滤液中各种离子的物质的量浓度由大到小的顺序是 .
②将滤渣洗涤干燥,置于酒精蒸汽中并加热,黑色粉状固体逐渐变成红色固体,同时产生一种在常温下有刺激性气味的液体,该反应的化学方程式是 .
(3)将碱式碳酸铜与过量的木炭混合加热,也能得到(2)②所得的红色固体,该反应的化学方程式是 .
(4)铜及其合金用途广泛,常见的铜的合金有黄铜(铜锌合金)、青铜(铜锡合金)等.现有 w g黄铜样品,放入足量的稀盐酸中,产生V mL气体(标准状况下),则样品中铜和锌的物质的量之比是 (用含w、V的代数式表示).