题目内容
【题目】KMnO4在实验室和工业生产中有广泛用途。
Ⅰ.某小组拟用酸性KMnO4溶液与H2C2O4溶液(弱酸)的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L KMnO4溶液)/mL | m(MnSO4固体)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.0 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
(1)完成上述反应原理的离子反应方程式_______________________。
(2)上述实验①②是探究____________对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则a为___________;乙是实验需要测量的物理量,则表格中“乙”应填写___________;上述实验②④是探究_________对化学反应速率的影响。
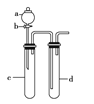
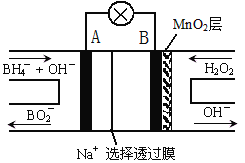
Ⅱ.某化学小组利用如图装置进行实验证明氧化性:KMnO4>Cl2>Br2。限选试剂:KBr溶液、KMnO4、浓盐酸、浓硫酸。
(3)装置d中观察到的现象为____________________;此实验装置的不足之处是无尾气吸收装置,请写出处理尾气的离子方程式_____________________。
【答案】(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)温度;1.0;t(溶液褪色时间)/s;催化剂
(3)溶液变为棕(橙)黄色;Cl2+2OH–=Cl–+ClO–+H2O
【解析】
试题分析:(1)酸性KMnO4溶液与H2C2O2发生氧化还原反应,MnO4-被还原为Mn2+,H2C2O2被氧化为CO2,结合离子方程式的电荷守恒和反应环境可知,要有H+参与反应,根据得失电子数守恒和电荷守恒来配平可得反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,通过比较实验①②的反应条件可知,实验①②可探究温度对反应速率的影响;实验②③中的H2C2O4溶液的加入体积不同,故要探究H2C2O4溶液浓度不同对反应速率的影响,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积均为6mL,故甲应为V(蒸馏水)/mL,a的值为1.0;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短,故乙要测量的物理量是溶液褪色的时间;实验②④中不同之处在于④中使用了催化剂硫酸锰,所以是探究催化剂对化学反应速率的影响;
(3)根据在氧化还原反应中,氧化剂的氧化性强于氧化产物,故要实验证明氧化性;KMnO4>Cl2>Br2,需用KMnO4将Cl2氧化出,用Cl2将Br2氧化出,故a中应放浓盐酸,c中放KMnO4溶液,通过KMnO4能将浓盐酸中的Cl-氧化为Cl2可证明氧化性KMnO4>Cl2;d中放KBr溶液,通过Cl2与KBr溶液反应置换出Br2可以证明氧化性Cl2>Br2,由于c中有氯气生成,即有黄绿色气体产生,在d中氯气将KBr溶液氧化为单质溴,溶液变为棕黄色,由于氯气有毒,故应有尾气处理装置,一般用氢氧化钠溶液吸收,反应的离子方程式为Cl2+2OH–=Cl–+ClO–+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要490 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。
(3)配制时,所需的玻璃仪器除量筒、烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);
(4)配制溶液有如下(未按顺序排列):a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容等操作。 其中摇匀的前一步操作是 ;(填写字母)
(5)在下列配制过程示意图中,有错误的是(填写序号) 。
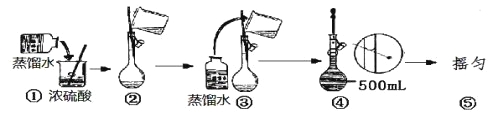
(6)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是_________
A.未经冷却趁热将溶液注入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 | D.未洗涤烧杯和玻璃棒 |