题目内容
【题目】Ⅰ、下列转化关系中,X、Y是生活中生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题:
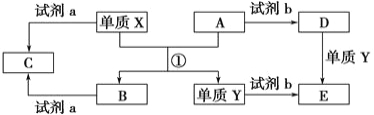
(1)请写出反应①的化学方程式_____________________。
(2)试剂a是_________溶液(写一种即可)
(3)若试剂b是H 2 SO 4 ,工业上用E、H 2 SO 4 和NaNO 2 为原料制取高效净水剂Y(OH)SO 4 ,已知还原产物为NO,则该反应的化学方程式是________________________。
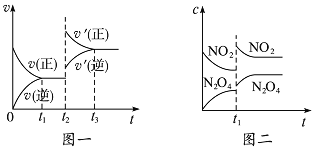
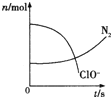
Ⅱ、(1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.
该反应的离子方程式是___________________。
(2)氮氧化合物是大气污染的重要盐因素,将NOx转化为无害物质是当前研究的重要课题。
①下式中X必须为无污染的物质,系数n可以为0。
NO2+G![]() N2+H2O+nX(未配平的反应式)。
N2+H2O+nX(未配平的反应式)。
下列化合物中,满足上述反应式中的G是________(填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
② 若G为天然气的主要成分,则X为____________,n=__________。
【答案】Ⅰ.(1)Fe2〇3+2Al![]() 2Fe+AlO3(1分)(2)NaOH或HCl(1分)
2Fe+AlO3(1分)(2)NaOH或HCl(1分)
(3)2FeSO4+H2SO4+2NaNO2=2Fe(OH)2SO4+Na2SO4+2NO↑(2分)
II.(1)2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-(2分〉
(2)①ad(2分〉②CO2(1分)1(2分)
【解析】
试题分析:Ⅰ.已知X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,说明A为Fe2O3,X为铝,它们通过铝热反应生成氧化铝(B)和铁(单质Y);D与Fe反应生成E,则试剂b为盐酸,D、E分别是氯化铁和氯化亚铁。
(1)反应①是铝与氧化铁发生铝热反应,化学方程式为Fe2O3+2Al![]() 2Fe+Al2O3;
2Fe+Al2O3;
(2)B还是氧化铝,是两性氧化物,因此试剂a是NaOH或HCl;
(3)若试剂b为硫酸,则E为FeSO4(铁的化合价为+2价)→Fe(OH)SO4(铁的化合价为+3价),而NaNO2(氮的化合价为+3价)→NO(氮的化合价为+2价),根据电子得失守恒、质量守恒定律配平,反应化学方程式为2FeSO4+H2SO4+2NaNO2===2Fe(OH)SO4+Na2SO4+2NO↑。
II. (1)根据图像可知次氯酸根离子的物质的量减少,氮气的物质的量增加,因此次氯酸根离子是反应物,且作氧化剂,氮气是氧化产物,因此反应的离子方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+ 5Cl-;
(2)①将NO2变成无害的N2中,氮元素的化合价降低了,二氧化氮做氧化剂,需要加入还原剂,在下列四种物质:a.NH3 b.CO2 c.SO2 d.CH3CH2OH中,能被二氧化氮氧化具有还原性的物质有乙醇和NH3,答案选ad;
②若G为天然气的主要成分,G是甲烷,甲烷被NO2氧化生成CO2,所以X为CO2;反应中1molNO2得到4mol电子,生成1mol氮气需要转移8mol电子,1mol甲烷失去8mol电子,因此根据电子得失守恒可知n=1。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案