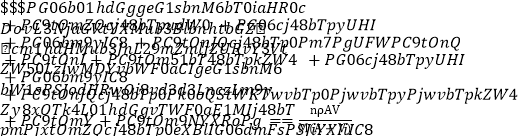题目内容
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
【答案】 Na2SiO3、Na2BeO2 BeO22-+4H+=Be2++2H2O cefd 蒸发结晶时,向溶液中持续通入氯化氢气体 MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O 产生污染环境的气体(合理即可) Fe3+ 4 90%
【解析】考查化学工艺流程,(1)旧铍铜原件的成分BeO、CuS、FeS、SiO2,根据信息I,BeO属于两性氧化物,CuS不与氢氧化钠溶液反应,FeS不与氢氧化钠反应,SiO2属于酸性氧化物,能与氢氧化钠溶液反应,因此滤液A中主要成分是NaOH、Na2SiO3、Na2BeO2;根据信息I,BeO2-与过量盐酸反应的离子方程式为 BeO22-+4H+=Be2++2H2O;(2)利用Be元素、铝元素化学性质相似,向溶液C中先加入过量的氨水,生成Be(OH)2沉淀,然后过滤、洗涤,再加入适量的HCl,生成BeCl2,合理步骤是cefd;②为了抑制Be2+的水解,因此需要在HCl的氛围中对BeCl2溶液蒸发结晶;(3)①根据信息,CuS中S转化为S单质,MnO2中Mn被还原为Mn2+,根据化合价升降法进行配平,其化学反应方程式为MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O ;②用浓硝酸作氧化剂,HNO3被还原成NO2,NO2有毒污染环境;(4)三种金属阳离子出现沉淀,根据浓度商与Ksp的关系,Cu2+转化成沉淀,c(OH-)= mol·L-1,Fe3+转化成沉淀,c(OH-)=
mol·L-1,Fe3+转化成沉淀,c(OH-)= mol·L-1,Mn2+转化成沉淀,c(OH-)=
mol·L-1,Mn2+转化成沉淀,c(OH-)=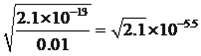 mol·L-1,因此首先沉淀的是Fe3+,为使Cu2+沉淀,此时c(OH-)=1×10-10mol·L-1,c(H+)=10-14/10-10=10-4mol·L-1,即pH=4,当pH>4时,Cu2+出现沉淀;(5)混合物中BeO的质量为1000×25%=250g,理论上得到Be的物质的量为250/25mol=10mol,实际得到Be物质的量为81/9mol=9mol,产率是9/10×100%=90%。
mol·L-1,因此首先沉淀的是Fe3+,为使Cu2+沉淀,此时c(OH-)=1×10-10mol·L-1,c(H+)=10-14/10-10=10-4mol·L-1,即pH=4,当pH>4时,Cu2+出现沉淀;(5)混合物中BeO的质量为1000×25%=250g,理论上得到Be的物质的量为250/25mol=10mol,实际得到Be物质的量为81/9mol=9mol,产率是9/10×100%=90%。