题目内容
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.3.4gNH3中含有的氢原子数为0.6NAB.0.5mol/LNa2CO3溶液中含有的Na+数为NA
C.标准状况下,11.2LH2O含有的原子数为1.5NAD.常温常压下,22.4L臭氧所含原子数为3NA
【答案】A
【解析】
A.3.4g氨气为0.2mol,1mol氨气中含有3mol氢原子,故0.2mol氨气中含有0.6mol氢原子,A正确;
B.未给出溶液体积无法计算粒子的物质的量,B错误;
C.标况下水为固液混合态,非气态,不能利用气体摩尔体积计算物质的量,C错误;
D.常温常压下气体摩尔体积不是22.4L/mol,故臭氧的原子数不为3NA,D错误;
故选A。

【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置:

选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ① | ③ |
【题目】三氯氧磷(POCl3)俗名磷酰氯、氧氯化磷,是重要的基础化工原料,可用于制取染料、农药,有机合成的氯化剂、催化剂和阻燃剂等。某化学实验小组模拟PCl3直接氧化法制备POCl3,其实验装置设计如下:
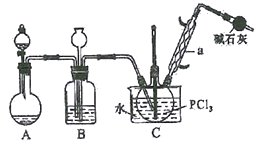
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)仪器a的名称是__________,装置A中发生反应的化学方程式为__________________。
(2)B中所装试剂为__________,B装置的作用除观察O2的流速之外,还有_____________________。
(3)C装置控制反应在60℃~65℃进行,其控温的主要目的是__________。
(4)实验制得的POCl3粗产品中常含有PCl3,可用__________方法提纯。
(5)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖,以防止在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀。
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是__________ (填标号)。
a.FeCl2 b.甲基橙 c.淀粉 d.NH4Fe(SO4)2
②Cl元素的质量百分含量为__________ (列出算式)。
③在步骤Ⅲ中,若无加入硝基苯的操作,所测Cl-元素含量将会__________(填“偏大”“偏小”或“不变”)。



