题目内容
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为五种短周期元素。
为五种短周期元素。![]() 原子的质子数与电子层数相同,
原子的质子数与电子层数相同,![]() 原子核外电子数是
原子核外电子数是![]() 原子最外层电子数的2倍,
原子最外层电子数的2倍,![]() 、
、![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。下列说法不正确的是( )
在周期表中的相对位置如图所示。下列说法不正确的是( )
|
|
| |
|
A.原子半径:![]()
B.热稳定性:![]() ;沸点:
;沸点:![]()
C.仅由![]() 、
、![]() 、
、![]() 三种元素形成的化合物中不可能含离子键
三种元素形成的化合物中不可能含离子键
D.![]() 、
、![]() 分子中每个原子最外层均满足8电子结构
分子中每个原子最外层均满足8电子结构
【答案】C
【解析】
X、Y、Z、M、W为5种短周期元素,X的质子总数与电子层数相同,则X为H元素;Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,则Z为O元素,可推知Y为N元素、M为F元素、W为Si,据此判断即可。
综上所述:X为氢、Y为氮、Z为氧、M为氟、W为硅;则
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Si>N>O>F>H,故A正确;
B.XM为HF,X2Z为H2O,元素的非金属性越强,其气态氢化物越稳定,由于非金属性F>O,故HF>H2O正确;沸点:H2O>NH3,故B正确;
C.H、N、O三种元素形成的化合物可以是硝酸铵,硝酸铵中既有离子键又有共价键,故C错误;
D.YM3、WM4分别为NF3、SiF4,两种物质每个原子最外层均满足8电子结构,故D正确;
故答案为C。

 培优口算题卡系列答案
培优口算题卡系列答案【题目】合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知标况下,5.6LCH4与水蒸气完全反应时吸收51.5KJ的热量,请写出该反应的热化学方程式____;
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____。
②在该温度下,计算该反应的平衡常数K=____。
③下列选项中能表示该反应已达到平衡状态的是____
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C (CH4) = C (CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H2![]() 2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是____;
2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是____;
容 器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | span>φ丙 | ν丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
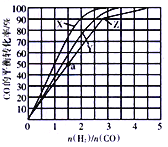
(4)合成气制甲醚的反应方程式为2CO(g) + 4H2(g)![]() CH3OCH3(g)+ H2O(g) △H = b kJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、 压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如下图所示。
CH3OCH3(g)+ H2O(g) △H = b kJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、 压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如下图所示。

① 290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是____;
② b____0,(填“>”或“<”或“=”)理由是____。