题目内容
【题目】以下是有关SO2、Cl2的性质实验.
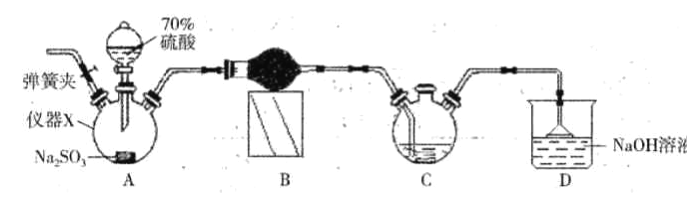
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质. 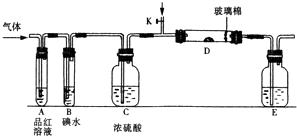
若从左端分别通入SO2和Cl2 , 装置A中观察到的现象是否相同?(填“相同”或“不相同”); 若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为E中盛有溶液.
(2)若装置B中装有5.0mL 1.0×10﹣3mol/L碘水,当通入足量Cl2完全反应后,共转移了5.0×10﹣5mol电子,该反应的化学方程式为 .
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) , 则可以看到白色沉淀产生.
A.氨水
B.稀盐酸
C.稀硝酸
D.氯化钙.
【答案】
(1)相同;2SO2+O2  2SO3;NaOH
2SO3;NaOH
(2)5Cl2+I2+6H2O=2HIO3+10HCl
(3)AC
【解析】解:(1)①二氧化硫能和有色物质反应生成无色物质,所以二氧化硫有漂白性;氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO2和Cl2 , 装置A中观察到的现象相同,都使品红褪色;二氧化硫和氧气在五氧化二钒作催化剂、加热条件下能发生氧化还原反应生成三氧化硫,反应方程式为 2SO2+O2  2SO3 , E为尾气处理,吸收多余的SO2和Cl2应盛有氢氧化钠溶液,所以答案是:相同;2SO2+O2
2SO3 , E为尾气处理,吸收多余的SO2和Cl2应盛有氢氧化钠溶液,所以答案是:相同;2SO2+O2  2SO3;NaOH;
2SO3;NaOH;
(2.)若装置B中装有5.0mL 1.0×10﹣3mol/L的碘水,当通入足量Cl2完全反应后,转移的电子为5.0×10﹣5mol,令碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10﹣3L×1.0×10﹣3mol/L×2×a=5.0×10﹣5mol,解得a=+5,所以碘单质被氧化为HIO3 , 则该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl,所以答案是:5Cl2+I2+6H2O=2HIO3+10HCl;
(3.)将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量试剂仍然无法观察到沉淀产生,说明不发生反应:A、氨水加入后生成亚硫酸铵,亚硫酸根和钡离子生成沉淀,故A正确;B、稀盐酸加入后不反应,故B错误;C、稀硝酸溶液具有强氧化性,将二氧化硫氧化成硫酸根,与钡离子生成硫酸钡沉淀,故C正确;D.氯化钙溶液和二氧化硫不反应,故D错误;所以答案是:AC.
【考点精析】解答此题的关键在于理解氯气的化学性质的相关知识,掌握氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
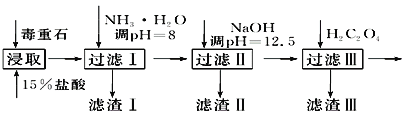
(1)毒重石用盐酸浸取前需充分研磨,目的是_______________________________________;实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯 b.一定容积的容量瓶 c.玻璃棒 d.滴定管
(2)查阅有关资料获得沉淀各种杂质离子的pH见下表:
沉淀杂质离子 | Ca2+ | Mg2+ | Fe3+ |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去______(填离子符号);滤渣Ⅱ中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_____________________(已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9)。
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。已知:2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O Ba2++CrO
+H2O Ba2++CrO![]() ===BaCrO4↓
===BaCrO4↓
步骤Ⅰ.准确移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入几滴酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ.准确移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(选填“上方”或“下方”)。BaCl2溶液的浓度为________________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则所测得Ba2+浓度测量值将________(选填“偏大”或“偏小”)。