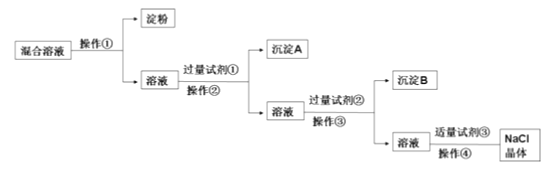
题目内容
【题目】在无色透明的酸性溶液中,能大量共存的离子组是( )
A.Al3+、NH4+、Cl、HCO3B.Na+、NO3、SO42-、Fe2+
C.Na+、Mg2+、Cl、SO42-D.Fe3+、K+、Cl、NO3
【答案】C
【解析】
A. 在酸性溶液中,HCO3与H+不能大量共存,A不合题意;
B. Fe2+呈浅绿色,B不合题意;
C. 在酸性溶液中,Na+、Mg2+、Cl、SO42-都能大量存在,C符合题意;
D. Fe3+呈棕黄色,D不合题意。
故选C。

【题目】碱式硫酸铁[Fe(OH)SO4]可用做净水剂、媒染剂等。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的部分工艺如下:
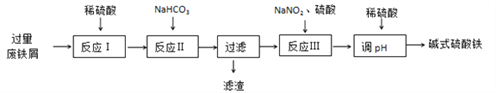
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应Ⅰ中氧化还原反应的离子方程式__________________ 、 __________________。
(2)反应Ⅱ中加入NaHCO3调节体系的pH在_____________范围内。
(3)反应Ⅲ中生成的气体遇空气变红棕色,该反应的离子方程式是_________________。
(4)若反应Ⅲ中通入O2可减少NaNO2的用量,当消耗1molO2可节约n(NaNO2)=____mol。
(5)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为____________________________
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
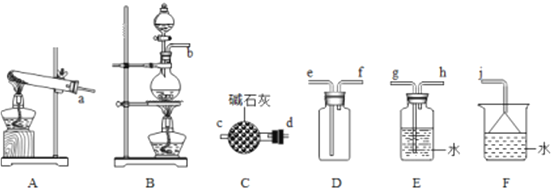
(1)氨气的制备
①用A装置可制备哪些常见气体_________,工业上制取氨气的化学方程式为____________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,向硬质玻璃管Y中加入少量催化剂并充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量无色液珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |