题目内容
(8分)在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
(1)x=__________(有过程)
(2)温度降低,K值增大,则正反应是_________(填“放热”或“吸热”)反应。
(3)B的转化率为_____ ____(有过程)。
(4)能判断该反应达到平衡状态的依据是________(填编号)
 xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:(1)x=__________(有过程)
(2)温度降低,K值增大,则正反应是_________(填“放热”或“吸热”)反应。
(3)B的转化率为_____ ____(有过程)。
(4)能判断该反应达到平衡状态的依据是________(填编号)
| A.混合气体的密度不变 |
| B.容器中的压强不再变化 |
| C.生成D的反应速率是生成B的反应速率的2倍 |
| D.单位时间内生成3molA,同时生成1molB |
(1) 1 (2)放热 (3)40% (4)BC
(1)C的浓度为0.2mol·L-1,则生成C是0.4mol。根据变化量之比是相应的化学计量数之比可知,x=1。
(2)温度降低,K值增大,说明平衡向正反应方向移动,所以正反应是放热反应。
(3)根据方程式可知,消耗B是0.4mol,所以B的转化率是0.4mol÷1.0mol×100%=40%。
(4)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,A不正确。根据方程式可知,反应是体积减小的,所以压强也是减小的,因此选项B正确。C中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。D中反应速率的方向是相同的,不正确。答案选BC。
(2)温度降低,K值增大,说明平衡向正反应方向移动,所以正反应是放热反应。
(3)根据方程式可知,消耗B是0.4mol,所以B的转化率是0.4mol÷1.0mol×100%=40%。
(4)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,A不正确。根据方程式可知,反应是体积减小的,所以压强也是减小的,因此选项B正确。C中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。D中反应速率的方向是相同的,不正确。答案选BC。

练习册系列答案
相关题目
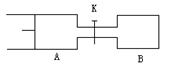
 2Z + W ;(X、Y、Z、W均为气体,正反应为放热反应),达平衡时,V(A)=1.2 a L。试回答:
2Z + W ;(X、Y、Z、W均为气体,正反应为放热反应),达平衡时,V(A)=1.2 a L。试回答: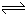 xC(g)+2D(g) ;△H>0,经5min后测知D的浓度为0.5mol/L,
xC(g)+2D(g) ;△H>0,经5min后测知D的浓度为0.5mol/L, 2HBr(g)。
2HBr(g)。 2NH3达到平衡时( )
2NH3达到平衡时( ) HBr+HBrO当加入NaOH溶液后颜色变浅
HBr+HBrO当加入NaOH溶液后颜色变浅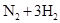
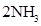 ,ΔH<0 为使氨的产率提高,理论上应采取低温高压的措施
,ΔH<0 为使氨的产率提高,理论上应采取低温高压的措施 2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是( )
2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是( )  2NO(g)+O2(g)。达到平衡状态的标志是( )
2NO(g)+O2(g)。达到平衡状态的标志是( )