题目内容
亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
(1)PCl3水解可制取亚磷酸:PCl3+3H2O===H3PO3+________。
(2)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3—。
H++H2PO3—。
①某温度下,0.10 mol·L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×
10-2 mol·L-1。求该温度下上述电离平衡的平衡常数K,写出计算过程。(H3PO3的第二步电离忽略不计,结果保留两位有效数字)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH________7(填“>”“=”或“<”)。
(3)亚磷酸具有强还原性,可使碘水褪色。该反应的化学方程式为________。
(4)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
①阴极的电极反应式为________________________;
②产品室中反应的离子方程式为_____________________。
(1)3HCl
(2)① H3PO3 ? ?H+ + H2PO3—
?H+ + H2PO3—
起始时浓度
(mol·L-1) 0.10 0 0
反应的浓度
(mol·L-1) 2.5×10-2 2.5×10-2 2.5×10-2
平衡时浓度
(mol·L-1) 0.10-2.5×10-2 2.5×10-2 2.5×10-2
K=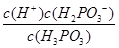 =8.3×10-3 ②>
=8.3×10-3 ②>
(3)H3PO3+I2+H2O===2HI+H3PO4
(4)①2H2O+2e-===H2↑+2OH-
②HPO32—+2H+===H3PO3
或HPO32—+H+===H2PO3—、H2PO3—+H+===H3PO3
解析

已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液;a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
A.c(H+ )
B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
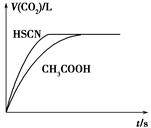
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如下图所示,则同温度时HX的电离平衡常数_ ____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值)。
(5)标准状况下,将1.12L CO2通入100mL 0.75mol·L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
| A.[Na+]>[Cl-]>[OH-]>[H+] |
| B.[Na+]=[Cl-]>[H+]>[OH-] |
| C.[Na+]=[Cl-]>[OH-]>[H+] |
| D.[Cl-]>[Na+]>[OH-]>[H+] |


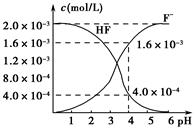
 Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7 2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O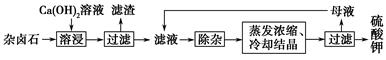
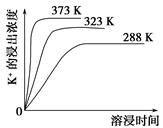

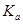 =____________mol/L。
=____________mol/L。