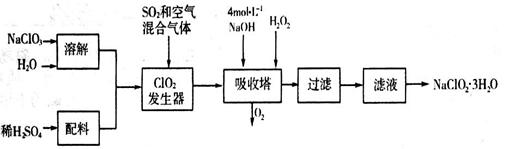
题目内容
酸碱中和滴定在生产实际中有着广泛的应用。室温时,用0.250 mol/LNaOH溶液滴定25.0 mL的一元酸HR溶液时,溶液的pH变化情况如图所示,其中a点表示两种物质恰好完全反应。请回答下列问题:
(1)该一元酸HR溶液的物质的量浓度为_______________。
(2)图中x_____7(填“>”、“<”或“=”),其原因是___________________(用离子方程式表示)。
(3)滴定到a点时,溶液中c(OH-)--c(HR)="____mol/L" (用含x的代数式表示)。
(4)室温时,HR的电离常数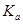 =____________mol/L。
=____________mol/L。
(1)0.20mol/L (2)> R-+H2O HR+OH- (3)10-x (4)5.0×10-6
HR+OH- (3)10-x (4)5.0×10-6
解析试题分析:(1)由于酸碱恰好发生中和反应时:n(NaOH)=n(HR),所以20ml×0.250 mol/L="25.0" mL×C(HR) mol/L,解得C(HR)= 0.20mol/L.(2)反应开始时C(H+)=10-3mol/L<C(HR) =0.20mol/L,说明HR为弱酸。二者恰好反应时生成的盐为强碱弱酸盐,在溶液中发生反应:R-+H2O HR+OH-,所以图中X>7,,溶液显碱性。(3)恰好中和时PH=X。C(H+)=10-Xmol/L,则C(OH-)(总)=KW÷C(H+)=10-14÷10-X=10(X-14)
HR+OH-,所以图中X>7,,溶液显碱性。(3)恰好中和时PH=X。C(H+)=10-Xmol/L,则C(OH-)(总)=KW÷C(H+)=10-14÷10-X=10(X-14)
C(OH-)(总)=C(OH-)(水电离)+C(OH-)(水解)=C(H+)+C(HR),所以C(OH-)(总) --C(HR) =C(H+)=10-Xmol/L。
(4)室温时,在溶液中存在电离平衡HR H++R-,电离常数Ka={C(H+)·C(R-)}÷C(HR)={10-3 mol/L×10-3 mol/L}÷{0.20mol/L-10-3 mol/L }=5.0×10-6 mol/L。
H++R-,电离常数Ka={C(H+)·C(R-)}÷C(HR)={10-3 mol/L×10-3 mol/L}÷{0.20mol/L-10-3 mol/L }=5.0×10-6 mol/L。
考点:考查酸碱中和滴定及强碱弱酸盐溶液中离子浓度的大小比较、弱酸的电离平衡常数等知识。

(1)常温下,将NH3·H2O与盐酸等体积混合,实验数据如下:
| 组别 | NH3·H2O | HCl | 混合溶液的pH值 |
| 甲 | c(NH3·H2O)=0.1mol·L-1 | c(HCl)=0.1mol·L-1 | pH=a |
| 乙 | NH3·H2O的pH=12 | HCl的pH=2 | pH=b |
| 丙 | c(NH3·H2O)="A" mol·L-1 | c(HCl)=0.1mol·L-1 | pH=c |
针对甲、乙、丙三组实验,回答下列问题:
①甲组反应后,溶液中离子浓度的大小顺序为__________________;
②乙组b 7(填“>”、“<”或“=”)
③丙组溶液混合后c=7,A 0.1mol·L-1(填“>”、“<”或“=”)
④甲中a=6,混合溶液中c(Cl-)-c(NH4+)= ____________mol·L-1 (列式表示结果,不能做近似计算)。(2)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH 的变化关系如右图所示。
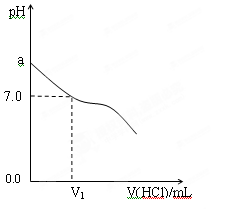
①a >7.0的理由是(用离子方程式表示) 。
②当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka (设混合后的体积为二者的体积之和,计算结果保留两位有效数字。)
 H++H2PO3—。
H++H2PO3—。