题目内容
短周期元素A、B、C、D中,0.5 mol A元素的离子得到6.02×1023个电子被还原为中性原子,(1)写出A、B、C、D四种元素的名称。
(2)画出C-和D原子的结构示意图。
(3)向B、C两元素形成的化合物的水溶液中逐滴滴入苛性钠溶液,有什么现象发生?写出有关反应的离子方程式。
解析:根据0.5 mol A离子得到6.02×1023个(即1 mol)电子被还原为中性原子,可确定A离子为二价离子,故其氧化物可表示为AO。结合AO+2HCl![]() ACl2+H2O,可求得
ACl2+H2O,可求得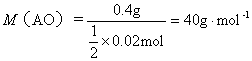 ,所以A原子的相对原子质量为24,即A原子的质量数为24。再根据A=Z+N,Z=N,求得Z=12,故可确定A为镁。然后分别根据题中B、C、D粒子的结构特征,可推得B为铝,C为氯,D为碳。最后完成(2)和(3)两小题。可见,本题的关键是确定A元素。确定A时,需用到阿伏加德罗常数、摩尔质量及化学方程式的计算,最后结合A原子结构特点来确定A元素。本题的综合性较强。
,所以A原子的相对原子质量为24,即A原子的质量数为24。再根据A=Z+N,Z=N,求得Z=12,故可确定A为镁。然后分别根据题中B、C、D粒子的结构特征,可推得B为铝,C为氯,D为碳。最后完成(2)和(3)两小题。可见,本题的关键是确定A元素。确定A时,需用到阿伏加德罗常数、摩尔质量及化学方程式的计算,最后结合A原子结构特点来确定A元素。本题的综合性较强。
答案:(1)A.镁 B.铝 C.氯 D.碳?
(2)![]() ?
?
(3)先有白色沉淀产生,到沉淀达到最大量后,沉淀又逐渐溶解,最后形成无色溶液。有关反应的离子方程式如下:Al3++3OH-![]() Al(OH)3↓ Al(OH)3+OH-
Al(OH)3↓ Al(OH)3+OH-![]()
![]() +2H2O。
+2H2O。

练习册系列答案
相关题目