��Ŀ����
����Ŀ����1��������������ֻ�������Ӽ�����______�����ڹ��ۻ��������____�������ڻ�ѧ������____��
��Ar ��CO2 ��Na2O2 ��H2SO4 ��NaCl ��NH4Cl ��CaO
��2��������Xn����N�����ӣ�X��������ΪA����ag X���⻯���к����ӵ����ʵ���Ϊ_________mol��
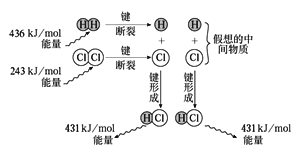
��3���۲���ͼ������1molH2��1molCl2��Ӧ�ͷŵ�����Ϊ______����������������ȼ�գ���Ӧ�����в�����ɫ�Ļ��棬�÷�Ӧ���γ�2 mol HClʱ�ͷŵ������������������ֵ���_______�����С������ȡ�����
���𰸡� �ݢ� �ڢ� �� ![]() ��A��N+n�� 183KJ С
��A��N+n�� 183KJ С
����������1����Ar��ϡ�����壬�����ڻ�ѧ������CO2������ֻ���ڹ��ۼ������ڹ��ۻ������Na2O2�Ǻ������Ӽ����ۼ������ӻ������H2SO4������ֻ���ڹ��ۼ������ڹ��ۻ������NaCl�д������Ӽ��������ӻ������NH4Cl�Ǻ������Ӽ����ۼ������ӻ������CaO �д������Ӽ��������ӻ������2��������Xn����N�����ӣ�X��������ΪA����X����������A��N������ag X���⻯���к����ӵ����ʵ���Ϊ![]() ����3����Ӧ�ȵ��ڶϼ����յ��������γɻ�ѧ�����ų��������IJ�ֵ��������2mol�Ȼ���ų���������2��431kJ��436kJ��243kJ��183kJ����������������ȼ�գ���Ӧ�����в�����ɫ�Ļ��棬˵����������ת��Ϊ���ܣ���˸÷�Ӧ���γ�2 mol HClʱ�ͷŵ�����С�������������ֵ��
����3����Ӧ�ȵ��ڶϼ����յ��������γɻ�ѧ�����ų��������IJ�ֵ��������2mol�Ȼ���ų���������2��431kJ��436kJ��243kJ��183kJ����������������ȼ�գ���Ӧ�����в�����ɫ�Ļ��棬˵����������ת��Ϊ���ܣ���˸÷�Ӧ���γ�2 mol HClʱ�ͷŵ�����С�������������ֵ��

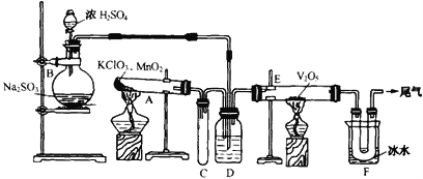
 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�