��Ŀ����
����Ŀ��������ͼ��ʾװ�ý�������
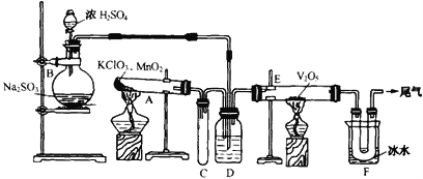
��1����ƿB�ڷ�����Ӧ�Ļ�ѧ����ʽ��________________���ڱ�ʵ���У�����ѡ����������75%���ҵ�Ũ���ᣬ�Է�����ԭ��________________��
��2��С�Թ�C��������________________��
��3�����ƿD��ʢ���Լ���____________��װ��D��3�������ǣ���_________����_______����_________��
��4��������E�ڷ�����Ӧ�Ļ�ѧ����ʽ��________________��
��5��װ��F��U�ι������ռ����ʵijɷ���________________��
��6����U�ι����ռ��������ʺ��٣�������ԭ������______________������ţ���
a��װ�������Բ���
b���Ƶõ�SO2�л�������H2S����ʹ�����ж���
c�������ٶȹ��졣
��7����U�ιܵ�����β���Ĵ���������________________����ط�Ӧ�Ļ�ѧ����ʽΪ________________��
���𰸡� ![]() ��Ũ������������������ᵼ�·�Ӧ��ϵ��H+Ũ�Ƚ��ͣ������ڷ�Ӧ���У���Ũ������������ƫС��ʹ������SO2����ˮ��������SO2���ݳ� ������ Ũ���� ����SO2 ʹSO2��O2����������Ȼ�� ͨ���۲����ݿ��������������������
��Ũ������������������ᵼ�·�Ӧ��ϵ��H+Ũ�Ƚ��ͣ������ڷ�Ӧ���У���Ũ������������ƫС��ʹ������SO2����ˮ��������SO2���ݳ� ������ Ũ���� ����SO2 ʹSO2��O2����������Ȼ�� ͨ���۲����ݿ�������������������� ![]() SO3 B ������������Һ����
SO3 B ������������Һ���� ![]()
�����������������������SO2��O2��Ӧ����SO3Ϊ��������Ҫ����O2��SO2�Ʊ�ԭ����ʵ��װ�õ����á�ʵ�������β���Ĵ�����ʵ����Ҫ���̵��ۺϷ�����
��������1��B��ƿ������Ũ�����Na2SO3��ȡSO2����Ӧԭ����Na2SO3+H2SO4![]() Na2SO4+SO2��+H2O���Ʊ�������һ��ѡ��75%���ҵ�Ũ���ᣬ��Ϊ��Ũ�����Ậˮ�����٣�������H2SO4���٣�H+Ũ�Ƚ��ͣ������ڷ�Ӧ����SO2���壬��ϡ�����Ậˮ�����࣬��ʹ������SO2����ˮ��������SO2���ݳ�����ȷ�𰸣�Na2SO3+H2SO4
Na2SO4+SO2��+H2O���Ʊ�������һ��ѡ��75%���ҵ�Ũ���ᣬ��Ϊ��Ũ�����Ậˮ�����٣�������H2SO4���٣�H+Ũ�Ƚ��ͣ������ڷ�Ӧ����SO2���壬��ϡ�����Ậˮ�����࣬��ʹ������SO2����ˮ��������SO2���ݳ�����ȷ�𰸣�Na2SO3+H2SO4![]() Na2SO4+SO2��+H2O����Ũ�����Ậˮ�����٣�������H2SO4���٣�H+Ũ�Ƚ��ͣ������ڷ�Ӧ����SO2���壬��ϡ�����Ậˮ�����࣬��ʹ������SO2����ˮ��������SO2���ݳ�����2��A�м��Ⱥ�����O2��Cװ��ֻ����O2ͨ�����ƺ�û���κ����ã�����������������ʼ�պ㶨����B�и�������SO2�����Կ��ܻ�ʹD�е���Һ��������A�����C��ȫƿ�����á���ȷ�𰸣���ȫƿ�����ֹ����������3������ͨ��D��SO2��O2�ж���������ˮ������D��Һ����Ũ���ᣬ�Գ�ȥˮ�õ���������壬����D����ͨ��������������������ͨ�����������Ļ�ϱȣ���ʹ����õ���ϡ���ȷ�𰸣�Ũ���ᡢ�������塢����ͨ�����������Ļ�ϱȡ�����������塣��4��E�з�������SO2�Ĵ���������Ӧԭ��Ϊ2SO2+O2
Na2SO4+SO2��+H2O����Ũ�����Ậˮ�����٣�������H2SO4���٣�H+Ũ�Ƚ��ͣ������ڷ�Ӧ����SO2���壬��ϡ�����Ậˮ�����࣬��ʹ������SO2����ˮ��������SO2���ݳ�����2��A�м��Ⱥ�����O2��Cװ��ֻ����O2ͨ�����ƺ�û���κ����ã�����������������ʼ�պ㶨����B�и�������SO2�����Կ��ܻ�ʹD�е���Һ��������A�����C��ȫƿ�����á���ȷ�𰸣���ȫƿ�����ֹ����������3������ͨ��D��SO2��O2�ж���������ˮ������D��Һ����Ũ���ᣬ�Գ�ȥˮ�õ���������壬����D����ͨ��������������������ͨ�����������Ļ�ϱȣ���ʹ����õ���ϡ���ȷ�𰸣�Ũ���ᡢ�������塢����ͨ�����������Ļ�ϱȡ�����������塣��4��E�з�������SO2�Ĵ���������Ӧԭ��Ϊ2SO2+O2![]() 2SO3����ȷ�𰸣�2SO2+O2
2SO3����ȷ�𰸣�2SO2+O2![]() 2SO3����5����E�е�������SO2��O2��SO3�Ļ�����壬�ڱ�ˮ����ȴ��SO3����������F��U�ι��У�β������Ҫ����SO2��O2����ȷ�𰸣�SO3����6��a��װ�õ������Բ���ʱ����������й¶����Ӧ���ɵ�SO3��Ȼ���٣�U�ι����ռ�����SO3Ҳ�ͻ���١�b��B��Cװ���ж�����������H2S���壬��D�е�Ũ����Ҳ������H2S����SO2�����b�����ܡ�c�������ٶȸ���ʱ��������SO2���ܼ�ʱ���²���E�з�����Ӧ����Ȼ����U�ι����ռ�����SO3���٣�����Ӧ��ѡ��b����ȷ��b����7��β����SO2��O2����Ҫ��������SO2��������NaOH��Һ�������ա���ȷ�𰸣���NaOH��Һ���ա�SO2+2NaOH=Na2SO3+H2O��
2SO3����5����E�е�������SO2��O2��SO3�Ļ�����壬�ڱ�ˮ����ȴ��SO3����������F��U�ι��У�β������Ҫ����SO2��O2����ȷ�𰸣�SO3����6��a��װ�õ������Բ���ʱ����������й¶����Ӧ���ɵ�SO3��Ȼ���٣�U�ι����ռ�����SO3Ҳ�ͻ���١�b��B��Cװ���ж�����������H2S���壬��D�е�Ũ����Ҳ������H2S����SO2�����b�����ܡ�c�������ٶȸ���ʱ��������SO2���ܼ�ʱ���²���E�з�����Ӧ����Ȼ����U�ι����ռ�����SO3���٣�����Ӧ��ѡ��b����ȷ��b����7��β����SO2��O2����Ҫ��������SO2��������NaOH��Һ�������ա���ȷ�𰸣���NaOH��Һ���ա�SO2+2NaOH=Na2SO3+H2O��

����Ŀ���ܼ��仯�����Ӧ�����������ء�������Ⱦ�ϵȡ�
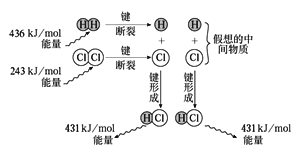
(1)CoO��һ���������Ӽ�����ͨ����Ӧ�٢��Ʊ���
��2Co(s)+O2(g)=2CoO(s) ��H1=akJ��mol-1
��2CoCO3(s) =CoO(s) + CO2 (g) ��H2=akJ��mol-1
��Ӧ2Co(s)+O2(g)+2CO2(g)=2CoO3(s) �Ħ�H=_________��
(2)ij﮵�صĵ���ʿɴ���Li+����ط�ӦʽΪ��LiC6+CoO2![]() C6+LiCoO2
C6+LiCoO2
�ٵ�طŵ�ʱ�������ĵ缫��ӦʽΪ_________��Li+��______�ƶ��������������������
��һ�ֻ��յ缫��CoԪ�صķ����ǣ���LiCoO2��H2O2��H2SO4��Ӧ����CoSO4���÷�Ӧ�Ļ�ѧ����ʽΪ___________________��
(3)BASF��ѹ���Ʊ��������������ѭ��������ͼ-1��ʾ����ѭ�����ܷ�Ӧ����ʽΪ_________________(��Ӧ���������г�)

(4)ij���ܴ�����ͬʱ��ȥ�����ͳ�β���е�̼��(C)��NOx����ͬ�¶��£���10molģ��β�����ɷ���������ʾ������ͬ������ͨ���ô�����������в���(CO2��N2��N2O)��NO��������ݽ����ͼ-2��ʾ.
ģ��β�� | ���� | ̼�� | ||
NO | O2 | He | ||
���������������������� | 0.25% | 5% | 94.75% | a mol |

��380��ʱ������ų��������к�0.45 mol O2��0.0525 mol CO2����Y�Ļ�ѧʽΪ__________________��
��ʵ������в���NOģ��NOx,����������NO2��ԭ����______________________��