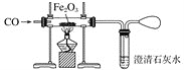
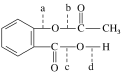
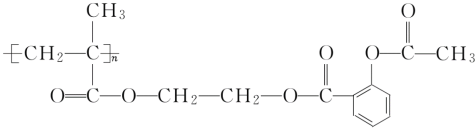题目内容
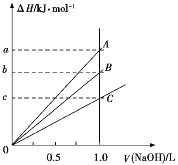
【题目】T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )

A. 平衡时X、Y的转化率相同
B. 达到平衡后将容器体积压缩为1 L平衡向正反应方向移动
C. T ℃时,该反应的化学方程式为X(g)+Y(g)![]() 2Z(g),平衡常数K=40
2Z(g),平衡常数K=40
D. T ℃时,若起始时X为0.71 mol,Y为1.00 mol,则平衡时Y的转化率约为60%
【答案】D
【解析】
根据图示,X、Y为反应物,Z为生成物,10 s时达到平衡。在0~10 s内,Z增加1.60 mol,X减少0.80 mol,Y减少0.80 mol,由于X、Y起始物质的量不同,故平衡时X、Y的转化率不同,A项不正确;根据Δn(X):Δn(Y):Δn(Z)=0.80 mol:0.80 mol:1.60 mol=1:1:2,得T°C时,该反应的化学方程式为:X(g)+Y(g)![]() 2Z(g),由于反应前后气体体积不变,达到平衡后,将容器体积压缩为1 L,平衡不移动,B项不正确;达到平衡时,c(X)=0.40 mol/2 L=0.20 mol/L,c(Y)=0.20 mol/2 L=0.10 mol/L,c(Z)=1.60 mol/2 L=0.80 mol/L,平衡常数K=
2Z(g),由于反应前后气体体积不变,达到平衡后,将容器体积压缩为1 L,平衡不移动,B项不正确;达到平衡时,c(X)=0.40 mol/2 L=0.20 mol/L,c(Y)=0.20 mol/2 L=0.10 mol/L,c(Z)=1.60 mol/2 L=0.80 mol/L,平衡常数K=![]() =32,C项不正确;若起始时X为0.71 mol,Y为1.00 mol,则:
=32,C项不正确;若起始时X为0.71 mol,Y为1.00 mol,则:
X(g) + Y(g)![]() 2Z(g)
2Z(g)
起始(mol) 0.71 1.00 0
改变(mol) x x 2x
平衡(mol) 0.71-x 1.00-x 2x
由于温度不变,K不变,故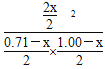 =32,解得x=0.60,故平衡时Y的转化率为60%。
=32,解得x=0.60,故平衡时Y的转化率为60%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】含+6价铬的废水毒性强,对环境污染严重。化工厂常用SO2处理含铬废水,其工艺流程如下图所示:

已知:Cr2O72- + H2O ![]() 2CrO42- + 2H+
2CrO42- + 2H+
(1)将吸收塔中1mol Cr2O72-与SO2反应的热化学方程式补全。
Cr2O72-(aq) + __SO2(g) + ___ ___ + ___ +___ ΔH = -1145 kJ/mol
(2)其他条件不变,研究吸收塔中pH对反应的影响。
pH | 2 | 4 | 6 |
Cr(+6) 最大去除率 | 99.99% 达排放标准 | 99.95% 达排放标准 | 99.5% 未达排放标准 |
时间 | 30 min | 35 min | 45 min |
①由上述数据获得的结论有________。
②实际工业生产控制pH = 4左右的原因是________。
③下列说法不合理的是________。
a.该酸性含铬废水中一定含有CrO42-,pH越大其含量越高
b.其他条件不变,增大压强,吸收塔中反应的K增大,有利于除去Cr(+6)
c.理论上看,SO32-、Fe2+等也可以用于除去Cr(+6)
(3)其他条件不变,研究温度对Cr(+6)去除率的影响(如图1所示)。


30min前相同时间内,80℃的Cr(+6)去除率比40℃高,30min后80℃的Cr(+6)去除率低,原因分别是_______;_______。
(4)图2为Cr(+3)微粒物质的量分数随溶液pH的变化关系示意图,中和池中应控制pH范围为_________。
(5)废水中Cr(+6)总浓度为a×10-3 mol/L,处理1000 L废水,去除率要求达到99.95%,理论上需要SO2物质的量为_________mol(写计算式)。
【题目】某小组研究AgCl的溶解平衡:向10 mL 1mol/L KCl 溶液中加入1 mL 0.2 mol/LAgNO3溶液,将浑浊液均分为2份,进行如下实验:
实验序号 | 实验操作 | 实验现象 |
I | 将其中一份浑浊液过滤,向滤液中放入Mg条
| i. 滤液澄清透明,用激光照射有丁达尔现象。 ii. 放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊。 iii. 一段时间后开始出现棕褐色浑浊物,Mg条表面也逐渐变为棕褐色,产生气泡的速率变缓慢。 |
II | 向另一份浑浊液中放入大小相同的Mg条
| iv. 棕褐色浑浊物的量明显多于实验I,Mg条表面棕褐色更深,其他现象与ii、iii相同。 |
已知:AgOH不稳定,立即分解为Ag2O(棕褐色或棕黑色),Ag粉为黑色,AgCl、Ag2O可溶于浓氨水生成Ag(NH3)2+
(1)滤液所属分散系为________。
(2)现象ii中无色气泡产生的原因是_________(写出化学方程式)。
(3)现象iii中,导致产生气泡的速率下降的主要影响因素是________。
(4)甲认为Mg条表面的棕褐色物质中一定有Ag和Ag2O,其中生成Ag的离子方程式为____。
(5)甲设计实验检验Ag:取实验I中表面变为棕褐色的Mg条于试管中,向其中加入足量试剂a,反应结束后,继续向其中加入浓硝酸,产生棕色气体,溶液中有白色不溶物。
① 白色不溶物为_____(填化学式),棕色气体产生的原因是_____(写离子方程式)。
② 试剂a为________,加入试剂a的目的是________。
③ 该实验能证明棕褐色物质中一定有Ag的实验现象是________。
(6)甲进一步设计实验验证了Mg条表面的棕褐色物质中有Ag2O,实验方案是:取实验I中表面变为棕褐色的Mg条_________。
(7)综合上述实验,能说明存在AgCl(s) ![]() Ag+(aq) + Cl-(aq)的证据及理由有________。
Ag+(aq) + Cl-(aq)的证据及理由有________。