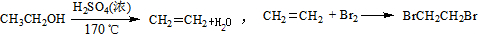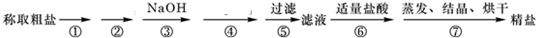题目内容
为了除去粗盐中Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)

(1)判断BaCl2已过量的方法是______;
(2)第④步中,相关的离子程式是______;
(3)若先用盐酸调PH再过滤,会对实验结果有影响吗?______(填“有”或“无”),试分析原因:______.

(1)判断BaCl2已过量的方法是______;
(2)第④步中,相关的离子程式是______;
(3)若先用盐酸调PH再过滤,会对实验结果有影响吗?______(填“有”或“无”),试分析原因:______.
(1)在粗盐提纯时,加入过量的氯化钡的目的是除去硫酸根离子,并将之除尽,氯化钡过量时,加入硫酸会产生白色沉淀,可以通过检验钡离子来确定氯化钡是否过量,所以取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,表明BaCl2已过量,
故答案为:取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,表明BaCl2已过量
(2)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,反应的方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,反应的实质是:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓;
(3)若先用盐酸调pH再过滤,那样Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成易溶于水的氯化镁、氯化钙、氯化钡等物质,从而影响氯化钠的纯度,
故答案为:有,在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度;
故答案为:取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,表明BaCl2已过量
(2)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,反应的方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,反应的实质是:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓;
(3)若先用盐酸调pH再过滤,那样Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成易溶于水的氯化镁、氯化钙、氯化钡等物质,从而影响氯化钠的纯度,
故答案为:有,在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度;

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目