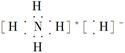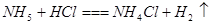题目内容
下列各组物质熔点高低的比较,正确的是( )
| A.Al>Mg>Na | B.MgO>KCl>NaCl |
| C.晶体硅>金刚石>碳化硅 | D.Cl2>Br2> I2 |
A
试题分析:A中都是金属晶体,金属晶体中,形成金属键的金属阳离子半径越小,电荷数越多,金属键越强,熔沸点越高,A正确;B中都是离子晶体,离子晶体中形成离子键的离子半径越小,电荷数越多,离子键越强,熔沸点越高,B不正确,应该是MgO >NaCl>KCl;C中都是原子晶体,熔点大小和共价键的强弱有关系,碳原子半径小于硅原子的比较,所以熔点大小顺序是金刚石>碳化硅>晶体硅,C不正确;D中都是分子晶体,形成分子晶体的分子间作用力越大,熔点越高,分子间作用力和相对分子质量有关系,相对分子质量越大,分子间作用力越大,所以D不正确,应该是I2>Br2>Cl2,答案A。
点评:该题是中等难度有的试题,试题综合性强,侧重对学生灵活运用基础知识解决实际问题的能量的培养。该题的关键是准确出物质的晶体类型,然后依据相应晶体类型的判断要求即可,有利于培养学生的逻辑推理能力和抽象思维能力。

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
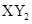 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5 ,元素Y的原子结构示意图为
,元素Y的原子结构示意图为 ,则X与Y形成的化合物的化学式为( )
,则X与Y形成的化合物的化学式为( )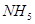 ,它的所有原子的最外层都符合相应稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
,它的所有原子的最外层都符合相应稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )