��Ŀ����
����Ŀ�����ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����������ȫ������ձ�����
��1��CO2����ϳ�DME�������ѣ��ǽ����ԴΣ�����о�����֮һ��
��2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g) ��H= -122.4kJ��mol-1
CH3OCH3(g) + 3H2O(g) ��H= -122.4kJ��mol-1
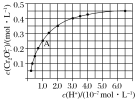
ij�¶��£���2.0 mol CO2(g) ��6.0 mol H2(g)�����ݻ�Ϊ2 L���ܱ������У���Ӧ����ƽ��ʱ���ı�ѹǿ���¶ȣ�ƽ����ϵ�� CH3OCH3(g) �����ʷ����仯�����ͼ��ʾ����P1_______P2���>����<����=������ͬ������T1��P1��T3��P3ʱƽ�ⳣ���ֱ�ΪK1��K3����K1________K3��T1��P1ʱH2��ƽ��ת����Ϊ______________��

���ں����ܱ������ﰴ�����Ϊ1��3���������̼��������һ�������·�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ��������������˵��ƽ��һ�����淴Ӧ�����ƶ�����______������ţ���
A����Ӧ���Ũ������ B�����������ܶȼ�С
C������Ӧ����С���淴Ӧ���� D��������ת���ʼ�С
��2����һ������CO2����ͨ���������Ƶ���Һ�У���������Һ�бߵμ�ϡ�������������������������������������ʵ����Ĺ�ϵ��ͼ������������ܽ��HCl�Ļӷ�������ش𣺵�����HCl �����ʵ���Ϊ1 molʱ����Һ���������ʵĻ�ѧʽ__________��a����Һ�и�����Ũ���ɴ�С�Ĺ�ϵʽΪ____________________________________��

��3��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp = 2.8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ������ǰNa2CO3��Һ��Ũ��Ϊ2��10��4 mol��L��1�������ɳ�������CaCl2��Һ����СŨ��Ϊ___________ mol��L��1��
���𰸡�> <57.1%CNa2CO3��NaClc(Na+) > c(Cl��) > c(HCO3��) > c(OH��) > c(H+) > c(CO32��)5.6��10-5
��������
��1����2CO2��g��+6H2��g��![]() CH3OCH3��g��+3H2O��g����H= -122.4kJ��mol-1���÷�ӦΪ������������ٵķ��ȷ�Ӧ������ƽ��ʱ�������ѵİٷֺ������¶����߶����١���ѹǿ������������÷�Ӧ��ƽ�ⳣ�����¶����߶���С����ͼ��֪������ͬ�¶���p1��p2���ֲ�ͬѹǿ�£�p1��Ӧ�Ķ����ѵİٷֺ����ϸߣ�����p1��p2������ͬѹǿ��T1��T3���ֲ�ͬ�¶��£�T3��Ӧ�Ķ����ѵİٷֺ����ϸߣ����ԣ�T1��T3�����ڻ�ѧƽ�ⳣ��ֻ���¶��йأ���������T1��P1��T3��P3ʱƽ�ⳣ���ֱ�ΪK1��K3����K1��K3��T1��P1ʱ����H2��ƽ��ת����ΪΪa����H2�ı仯��Ϊ6.0a��CO2��CH3OCH3��H2O�ı仯���ֱ�Ϊ2.0a��1.0a��3.0a����Ϊ�����ѵ��������Ϊ0.1������
CH3OCH3��g��+3H2O��g����H= -122.4kJ��mol-1���÷�ӦΪ������������ٵķ��ȷ�Ӧ������ƽ��ʱ�������ѵİٷֺ������¶����߶����١���ѹǿ������������÷�Ӧ��ƽ�ⳣ�����¶����߶���С����ͼ��֪������ͬ�¶���p1��p2���ֲ�ͬѹǿ�£�p1��Ӧ�Ķ����ѵİٷֺ����ϸߣ�����p1��p2������ͬѹǿ��T1��T3���ֲ�ͬ�¶��£�T3��Ӧ�Ķ����ѵİٷֺ����ϸߣ����ԣ�T1��T3�����ڻ�ѧƽ�ⳣ��ֻ���¶��йأ���������T1��P1��T3��P3ʱƽ�ⳣ���ֱ�ΪK1��K3����K1��K3��T1��P1ʱ����H2��ƽ��ת����ΪΪa����H2�ı仯��Ϊ6.0a��CO2��CH3OCH3��H2O�ı仯���ֱ�Ϊ2.0a��1.0a��3.0a����Ϊ�����ѵ��������Ϊ0.1������![]() ����֮�ã�H2��ƽ��ת����Ϊ57.1%�����ں����ܱ������ﰴ�����Ϊ1��3���������̼��������һ�������·�Ӧ�ﵽƽ��״�����ı䷴Ӧ��ijһ��������A. ��Ӧ���Ũ�������������������˷�Ӧ���Ũ�ȣ��ټ��������ķ�Ӧ�ʹƽ��������Ӧ�����ƶ��Ľ����Ҳ����������������Ũ�ȣ��������¶ȣ�ʹƽ�����淴Ӧ�����ƶ��Ľ���� B. ���������ܶȼ�С���п����Ǽ�С��Ӧ��Ũ��ʹƽ�������ƶ���Ҳ�п����Ǽ�С������Ũ�ȣ��罵���¶�ʹ����ˮҺ����ʹƽ�������ƶ��Ľ����C. ����Ӧ����С���淴Ӧ������ƽ��һ�����淴Ӧ�����ƶ���D. ������ת���ʼ�С������������������Ũ�ȣ��ټ�������������ʹƽ�������ƶ��Ľ����Ҳ�����������¶�ʹƽ�������ƶ��Ľ����������������˵��ƽ��һ�����淴Ӧ�����ƶ�����C����2����ͼ��֪����Ӧ���Է�Ϊ�����Σ�ǰ�������������ĵ�HCl����ֵ���֮��Ϊ3:2��˵��ԭ��Һ�е�����Ϊ̼���ƺ��������������������ʵ���֮��Ϊ2:1���������ʵ����ֱ���2mol��1mol��ͨ��1mol HClʱ����������ǡ�÷�Ӧ��ȫ����Һ����������ΪNa2CO3��NaCl��a����Һ����3mol NaCl��1molNaHCO3������̼��������ӵ�ˮ��̶ȴ��ڵ���̶������ԣ�������Ũ���ɴ�С�Ĺ�ϵʽΪc(Na+)��c(Cl-)��c(HC03-)��c(OH-)��c(H+)��c(CO32-)����3��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp = 2.8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mol��L-1�������ɳ�������CaCl2��Һ����СŨ��Ϊ
����֮�ã�H2��ƽ��ת����Ϊ57.1%�����ں����ܱ������ﰴ�����Ϊ1��3���������̼��������һ�������·�Ӧ�ﵽƽ��״�����ı䷴Ӧ��ijһ��������A. ��Ӧ���Ũ�������������������˷�Ӧ���Ũ�ȣ��ټ��������ķ�Ӧ�ʹƽ��������Ӧ�����ƶ��Ľ����Ҳ����������������Ũ�ȣ��������¶ȣ�ʹƽ�����淴Ӧ�����ƶ��Ľ���� B. ���������ܶȼ�С���п����Ǽ�С��Ӧ��Ũ��ʹƽ�������ƶ���Ҳ�п����Ǽ�С������Ũ�ȣ��罵���¶�ʹ����ˮҺ����ʹƽ�������ƶ��Ľ����C. ����Ӧ����С���淴Ӧ������ƽ��һ�����淴Ӧ�����ƶ���D. ������ת���ʼ�С������������������Ũ�ȣ��ټ�������������ʹƽ�������ƶ��Ľ����Ҳ�����������¶�ʹƽ�������ƶ��Ľ����������������˵��ƽ��һ�����淴Ӧ�����ƶ�����C����2����ͼ��֪����Ӧ���Է�Ϊ�����Σ�ǰ�������������ĵ�HCl����ֵ���֮��Ϊ3:2��˵��ԭ��Һ�е�����Ϊ̼���ƺ��������������������ʵ���֮��Ϊ2:1���������ʵ����ֱ���2mol��1mol��ͨ��1mol HClʱ����������ǡ�÷�Ӧ��ȫ����Һ����������ΪNa2CO3��NaCl��a����Һ����3mol NaCl��1molNaHCO3������̼��������ӵ�ˮ��̶ȴ��ڵ���̶������ԣ�������Ũ���ɴ�С�Ĺ�ϵʽΪc(Na+)��c(Cl-)��c(HC03-)��c(OH-)��c(H+)��c(CO32-)����3��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp = 2.8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mol��L-1�������ɳ�������CaCl2��Һ����СŨ��Ϊ![]() mol��L-1��
mol��L-1��