题目内容
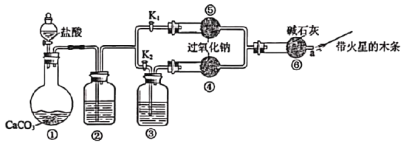
【题目】实验是学习和研究化学的基础。某课外兴趣小组设计了下列装置,验证二氧化碳与过氧化钠反应时需要有水存在。
回答下列问题:
I.二氧化碳的制备及纯化:
(1)装置①中反应的离子方程式是___。
(2)装置②中的试剂是___;装置③中的试剂是___。
II.实验验证:
步骤1:打开阀门K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开阀门K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(3)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是___。
(4)过氧化钠与二氧化碳反应的化学方程式为___。
III.实验反思:
(5)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠与二氧化碳发生了化学反应。”其理由是___。
【答案】CaCO3+2H+=Ca2++H2O+CO2↑ 饱和碳酸氢钠溶液 浓硫酸 步骤1中木条不复燃,步骤2中木条复燃 2Na2O2+2CO2![]() 2Na2CO3+O2 气体中有水,水也可与Na2O2反应产生O2,使木条复燃
2Na2CO3+O2 气体中有水,水也可与Na2O2反应产生O2,使木条复燃
【解析】
①中盐酸和碳酸钙反应生成二氧化碳,②用于除去HCl,应为饱和碳酸氢钠溶液,③应为浓硫酸,④⑤为对比试验,用于判断干燥的二氧化碳是否与过氧化钠反应,⑥可避免空气中的水、二氧化碳进入④⑤,最后用带火星的木条检验是否生成氧气。
Ⅰ(1)装置①中盐酸和碳酸钙反应生成二氧化碳,其反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(2)装置②用于除去HCl,应为饱和碳酸氢钠溶液,装置③应为浓硫酸,用于干燥二氧化碳,故答案为:饱和碳酸氢钠溶液;浓硫酸;
Ⅱ(3)步骤1:打开弹簧夹K2,关闭K1,生成的二氧化碳被干燥,步骤2为湿润的二氧化碳,可观察到步骤1中木条不复燃,步骤2中木条复燃,故答案为:步骤1中木条不复燃,步骤2中木条复燃;
(4)过氧化钠跟二氧化碳反应的化学方程式为:2Na2O2+2CO2![]() 2Na2CO3+O2,故答案为:2Na2O2+2CO2
2Na2CO3+O2,故答案为:2Na2O2+2CO2![]() 2Na2CO3+O2;
2Na2CO3+O2;
Ⅲ(5)水与过氧化钠反应生成氧气,不能证明二氧化碳与过氧化钠反应生成氧气使木条复燃,故答案为:气体中有水,水也可与Na2O2反应产生O2,使木条复燃。

【题目】根据下表回答问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中______(填元素符号)的非金属性最强;______(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:______。
(2)表中元素③的原子结构示意图是______。
(3)表中元素⑤、⑦的氢化物的稳定性顺序为______>______(填化学式)。
(4)表中元素最高价氧化对应水化物中酸性最强的是______(填化学式)。