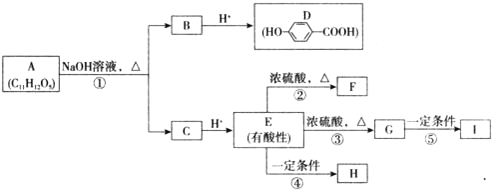
题目内容
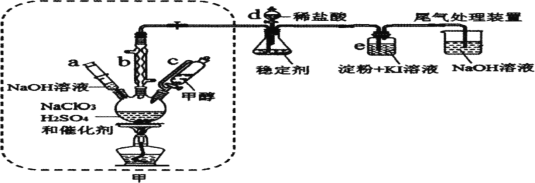
【题目】二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2,如图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
①ClO2的浓度较大时易分解,实验室用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I+8H+=2Cl+5I2+4H2O。
③![]()
请回答:
(1)比较仪器c和d,实验中c的优点是___。
(2)制备装置甲中需改进的一项措施是___。
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:___;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是___。
(4)下列有关说法正确的是___。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5ClO2-=Cl+4ClO2↑+2H2O
D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,ClO2的氧化能力是Cl2的2.5倍
(5)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用0.1000mol·L1Na2S2O3标准溶液滴定碘单质(I2+2S2O32-=2I+S4O62-),达到滴定终点时用去20.00mLNa2S2O3标准溶液,测得该水样中ClO2的含量为___mg·L1。
【答案】有利于液体顺利流下,防止甲醇挥发 水浴加热 4NaClO3+CH3OH+2H2SO4![]() 2Na2SO4+4ClO2↑+HCOOH+3H2O
2Na2SO4+4ClO2↑+HCOOH+3H2O
(或者4NaClO3+CH3OH+4H2SO4![]() 4ClO2↑+HCOOH+4NaHSO4+3H2O) 产生的CO2可稀释ClO2,防止ClO2浓度较大时分解 ACD 270
4ClO2↑+HCOOH+4NaHSO4+3H2O) 产生的CO2可稀释ClO2,防止ClO2浓度较大时分解 ACD 270
【解析】
装置甲中甲醇,![]() ,硫酸反应生成
,硫酸反应生成![]() ,加入氢氧化钠后硫酸被中和反应即停止,稳定剂用于吸收
,加入氢氧化钠后硫酸被中和反应即停止,稳定剂用于吸收![]() ,加入盐酸释放
,加入盐酸释放![]() ,淀粉碘化钾溶液用于检验
,淀粉碘化钾溶液用于检验![]() ,氢氧化钠溶液用于尾气吸收。
,氢氧化钠溶液用于尾气吸收。
(1)d是分液漏斗,添加盐酸时需要将分液漏斗活塞打开,便于液体顺利流下,但会导致液体的挥发,c是恒压漏斗,有利于液体顺利流下,减少甲醇的挥发,
故答案为:有利于液体顺利流下,减少甲醇的挥发;
(2)甲装置需控制反应温度60℃,酒精灯直接加热不利于温度的控制,60℃低于水的沸点,可采取水浴加热,受热均匀,便于控制温度,
故答案为:水浴加热;
(3)甲醇被氧化为甲酸(![]() ),
),![]() 还原生成
还原生成![]() ,硫酸生成硫酸钠,反应方程式为:
,硫酸生成硫酸钠,反应方程式为: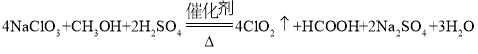 ,(或者4NaClO3+CH3OH+4H2SO4
,(或者4NaClO3+CH3OH+4H2SO4![]() 4ClO2↑+HCOOH+4NaHSO4+3H2O)
4ClO2↑+HCOOH+4NaHSO4+3H2O)
故答案为: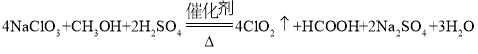 ,(或者4NaClO3+CH3OH+4H2SO4
,(或者4NaClO3+CH3OH+4H2SO4![]() 4ClO2↑+HCOOH+4NaHSO4+3H2O);
4ClO2↑+HCOOH+4NaHSO4+3H2O);
(4)A.![]() 可以中和硫酸并吸收
可以中和硫酸并吸收![]() ,A正确;
,A正确;
B.![]() 可以将碘离子氧化为碘单质,造成e中溶液显蓝色,故装置e的作用是检验是否产生
可以将碘离子氧化为碘单质,造成e中溶液显蓝色,故装置e的作用是检验是否产生![]() ,B错误;
,B错误;
C. 稳定剂吸收![]() ,生成
,生成![]() ,加盐酸后
,加盐酸后![]() 发生歧化反应释放
发生歧化反应释放![]() ,C正确;
,C正确;
D. 等物质的量的![]() 和
和![]() ,转移电子的物质的量之比为5:2,故
,转移电子的物质的量之比为5:2,故![]() 的氧化能力是
的氧化能力是![]() 的2.5倍,D正确;
的2.5倍,D正确;
答案选ACD;
(5)根据题目信息,![]() ,
,![]() 的物质的量为
的物质的量为![]() ,故
,故![]() 的物质的量为0.0004mol,质量为:
的物质的量为0.0004mol,质量为:![]() ,水样中
,水样中![]() 的含量为:
的含量为:![]() ,
,
故答案为:270

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。
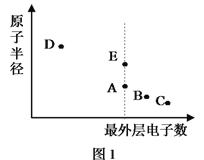
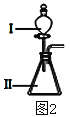
试回答:
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D离子所含电子数和质子数均相同的微粒是________________。(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的_________________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ___________,Ⅱ__________,观察到的实验现象是________________________。
(4)由以上五种元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有___________________________________;
②b与c反应的化学方程式为_________________________________。