题目内容
【题目】(1)①建筑上需要用到大量水泥、玻璃。生产水泥、玻璃中都用到的主要原料为_____(填字母)。
a. 纯碱 b. 石灰石 c. 黏土
②汽车工业大量使用橡胶轮胎,橡胶属于____________(填字母)。
a. 无机非金属材料 b. 金属材料 c. 有机高分子材料
③现代桥梁建造需要使用大量钢材,其中镀锌钢板镀锌的主要目的是_________ (填字母)。
a. 美化桥梁 b. 提高硬度 c. 提高耐腐蚀性
(2)洋蓟被人们冠以“蔬菜之皇”的美称,含有脂肪、蛋白质、糖类、维生素A、维生素C和丰富的钙、磷、铁等元素,其中:
①属于水溶性维生素的是_____________。
②属于人体所需微量元素的是_____________。
③脂肪在人体内水解生成高级脂肪酸和_____________________;糖类在人体中水解生成葡萄糖,写出葡萄糖在人体内氧化的化学方程式:________________________________________________。
(3)合理利用自然资源,防止环境污染和生态破坏。
①向燃煤中加入适量石灰石,可大大减少______________的排放。煤的气化是实现能源清洁化的重要途径,水煤气的主要成分是CO和_____________。
②明矾是一种常用的混凝剂,其净水原理是___________________________ (用离子方程式表示)。污水处理的方法很多,从化学角度看,处理酸性废水可采用________(选填“中和法”或“沉淀法”)。
③我国科学家证明了黄粉虫的幼虫可降解聚苯乙烯(![]() )这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:__________________________________________。
)这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:__________________________________________。
【答案】b c c 维生素C Fe 甘油 C6H12O6+6O2![]() 6CO2+6H2O SO2 H2 Al3++3H2O
6CO2+6H2O SO2 H2 Al3++3H2O ![]() Al(OH)3(胶体)+3H+ 中和法 n
Al(OH)3(胶体)+3H+ 中和法 n![]()
![]()
![]()
【解析】
(1)①生产水泥的原料是粘土和石灰石,生产玻璃的原料是纯碱、石灰石和石英;②材料分为金属材料、无机非金属材料、复合材料、有机高分子材料,利用题干提供的信息判断;③在原电池的正极金属可以被保护;
(2)①维生素A属于脂溶性维生素,维生素C为水溶性维生素;②人体中的常量元素主要有:氧、碳、氢、氮、钙、磷、钾、硫、钠、氯、镁;微量元素主要有:铁、钴、铜、锌、铬、锰、钼、氟、碘、硒;③脂肪在人体内水解的产物是高级脂肪酸和甘油;葡萄糖发生缓慢氧化反应生成二氧化碳和水;
(3)①向煤中加入石灰石作为脱硫剂,可以减少SO2的排放;水煤气的主要成分是一氧化碳和氢气;②明矾可水解生成具有吸附性的氢氧化铝胶体;③一定条件下,苯乙烯发生加成聚合反应生成聚苯乙烯。
据此分析解答。
(1)①制造水泥的原料是粘土和石灰石,制造玻璃的原料是纯碱、石灰石和石英,工业上制造水泥、玻璃和高炉炼铁都要用到的原料是石灰石,故答案为:b;
②天然橡胶是天然存在的有机高分子化合物,合成橡胶是人工合成的有机高分子化合物,因此橡胶属于有机高分子材料,故答案为:c;
③钢板镀锌形成的原电池中,金属铁为正极,可以防止锈蚀,所以钢板镀锌的主要目的是提高耐腐蚀性,故答案为:c;
(2)①维生素可分为脂溶性维生素和水溶性维生素两类,脂溶性维生素包括维生素A、维生素D、维生素E、维生素K等,水溶性维生素溶于水,有B族维生素和维生素C,故答案为:维生素C;
②人体中的常量元素主要有:氧、碳、氢、氮、钙、磷、钾、硫、钠、氯、镁;微量元素主要有:铁、钴、铜、锌、铬、锰、钼、氟、碘、硒等,故洋蓟中所含的人体所需的微量元素有铁,故答案为:Fe;
③脂肪在人体内水解的产物是高级脂肪酸和甘油,葡萄糖发生缓慢氧化反应生成二氧化碳和水,产生能量,反应的化学方程式为:C6H12O6+6O2 ![]() 6CO2+6H2O,故答案为:甘油;C6H12O6+6O2
6CO2+6H2O,故答案为:甘油;C6H12O6+6O2 ![]() 6CO2+6H2O。
6CO2+6H2O。
(3)①向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4;水煤气的主要成分是CO和H2,故答案为:SO2;H2;
②水在净化处理过程中加入明矾做混凝剂,因明矾水解生成具有吸附性的胶体,反应的离子方程式为Al3++3H2OAl(OH)3(胶体)+3H+;处理酸性废水可采用碱与酸发生中和反应,即中和法处理,故答案为:Al3++3H2OAl(OH)3(胶体)+3H+;中和法;
③一定条件下,苯乙烯发生聚合反应生成聚苯乙烯,反应方程式为:n![]() -CH=CH2
-CH=CH2![]()
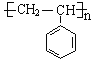 ,故答案为:n
,故答案为:n![]() -CH=CH2
-CH=CH2![]()
 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案


