题目内容
【题目】根据下列与转化关系,回答有关问题:

已知:CH3CHO在一定条件下可被氧化为CH3COOH。
(1)A的结构简式为_____,C试剂是_____(填化学式)。
(2)B溶液的作用是_____。
(3)④反应的化学方程式及反应类型分别为_____。
(4)由图示转化关系可知淀粉_____(填“部分水解”或“完全水解”)。某同学取图中混合液E,加入碘水,溶液不变蓝色,______(填“能”或“不能”)说明淀粉水解完全,原因是_____。
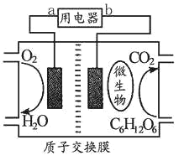
(5)以葡萄糖为燃料的微生物燃料电池如图所示,该电池_____(填“能”或“不能”)在高温下工作,酸性条件下负极电极反应的方程式_____。
【答案】CH2OH(CHOH)4CHO 新制Cu(OH)2悬浊液 中和稀硫酸 2CH3CH2OH+O2![]() 2CH3CHO+2H2O,氧化反应 部分水解 不能 I2与过量的NaOH溶液反应 不能 C6H12O6+6H2O-24e-=6CO2↑+24H+
2CH3CHO+2H2O,氧化反应 部分水解 不能 I2与过量的NaOH溶液反应 不能 C6H12O6+6H2O-24e-=6CO2↑+24H+
【解析】
(1)葡萄糖在碱性条件下与新制Cu(OH)2悬浊液反应;
(2)葡萄糖与新制Cu(OH)2悬浊液反应需要在碱性条件下;
(3)葡萄糖在酒化酶作用下可生成乙醇和CO2,乙醇被氧化为乙醛;
(4)淀粉如果部分水解,既能与新制Cu(OH)2悬浊液反应又能使碘水变蓝;I2与过量的NaOH溶液反应;
(5)该电池利用了微生物,不能在高温下工作,负极是葡萄糖失去电子变为二氧化碳。
(1)淀粉在酸性条件下水解的最终产物是葡萄糖,葡萄糖在碱性条件下与新制Cu(OH)2悬浊液反应,所以水解后先加NaOH溶液中和H2SO4后才可与新制Cu(OH)2悬浊液反应生成砖红色沉淀,故答案为:CH2OH(CHOH)4CHO;新制Cu(OH)2悬浊液;
(2)淀粉水解后产物为葡萄糖,葡萄糖与新制Cu(OH)2悬浊液反应需要在碱性条件下,所以水解后先加NaOH溶液中和H2SO4,故答案为:中和稀硫酸;
(3)葡萄糖在酒化酶作用下可生成乙醇和CO2,D为乙醇,乙醇被氧化为乙醛,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,氧化反应;
2CH3CHO+2H2O,氧化反应;
(4)淀粉如果部分水解,既能与新制Cu(OH)2悬浊液反应又能使碘水变蓝,由图示转化关系可知淀粉部分水解;某同学取图中混合液E,加入碘水,溶液不变蓝色,不能说明淀粉水解完全,因为I2与过量的NaOH溶液反应,故答案为:部分水解;不能; I2与过量的NaOH溶液反应;
(5)如图所示,该电池利用了微生物,不能在高温下工作,负极是葡萄糖失去电子变为二氧化碳,则酸性条件下负极电极反应的方程式为:C6H12O6+6H2O-24e-=6CO2↑+24H+,故答案为:不能;C6H12O6+6H2O-24e-=6CO2↑+24H+。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平衡常数 |
N2(g)+O2(g)=2NO(g) △H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 | c kJ/mol | d kJ/mol | K2 |
请写出t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式:______________________,t℃时该反应的平衡常数为__________ (用K1和K2表示)。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
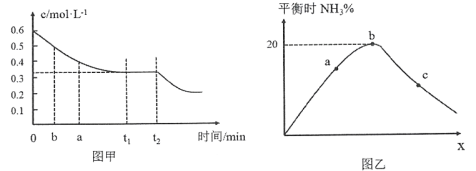
①图甲中0~t1 min内,v(N2)=_____mol·L-1·min-1;b点的v(H2)正_____a点的v(H2)逆(填“大于”“小于”或“等于”)。
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,保持温度和压强不变,又充入3 mol N2后,平衡________(填“向右移动”“向左移动”或“不移动”)。
(3)①科学家研究出以尿素为动力的燃料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,写出负极电极反应式:________________________________________________。

②理论上电池工作时,每消耗标准状况下2.24 L O2时,可产生的电量为________ (法拉第常数为96500C/ mol)。
【题目】下列实验操作、现象、结论、因果关系均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向淀粉溶液中滴加稀硫酸,加热,再加碘水 | 溶液变蓝 | 淀粉没有水解 |
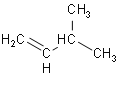
B | 将 |
| 有乙烯生成 |
C | 向 | 产生砖红色沉淀 | 葡萄糖具有还原性 |
D | 将乙醇加入浓硫酸中,快速加热到170℃,将产生的气体通入溴水 | 溴水褪色 | 不能证明有乙烯生成 |
A.AB.BC.CD.D