题目内容
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用.其工作流程如图1所示:
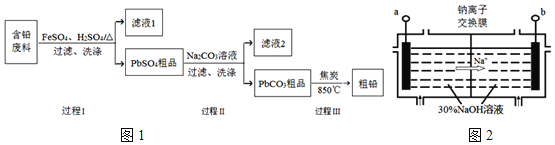
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是______.
(2)过程Ⅰ中,Fe2+催化过程可表示为:
![]()
![]() .
.
![]() 写出ii的离子方程式:______.
写出ii的离子方程式:______.
![]() 下列实验方案可证实上述催化过程.将实验方案补充完整.
下列实验方案可证实上述催化过程.将实验方案补充完整.
![]() 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
![]() ______.
______.
(3)过程Ⅱ的目的是脱硫.若滤液2中c(SO42-)=1.6molL-1,c(CO32-)=0.1molL-1,则PbCO3中______![]() 填“是”或“否”
填“是”或“否”![]() 混有PbSO4.
混有PbSO4.
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图2所示.将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发生反应:![]()
![]() 与外接电源的______极相连.
与外接电源的______极相连.
![]() 电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
![]() 与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
【答案】![]() 4
4![]()
![]()
![]() 取a中红色溶液少量,加入足量Pb,充分反应后,红色褪去 否 负
取a中红色溶液少量,加入足量Pb,充分反应后,红色褪去 否 负 ![]() 阻止HPbO2-进入阳极室被氧化
阻止HPbO2-进入阳极室被氧化
【解析】
(1)在催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,据此书写反应方程式;
(2)①根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,据此书写离子方程式;
②加入过量的Pb平衡逆向进行充分反应后,红色褪去;
(3)根据Ksp(PbCO3)=3.3×10-14和c(CO32-)=0.1molL-1计算出c(Pb2+)利用浓度积Qc和Ksp(PbSO4)之间的大小关系确定PbCO3中是否混有PbSO4;
(4)①根据钠离子的移动方向确定阴阳极;
②电解过程中,PbO2在阴极得电子,发生还原反应;
③钠离子交换膜只允许钠离子通过。
(1)根据题给化学工艺流程知,过程Ⅰ中,在催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,化学方程式为:![]()
![]()
![]() ;
;
(2)①催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变,根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,离子方程式为:![]() ;
;
②a实验证明发生反应i,则b实验需证明发生反应ii,实验方案为:
![]() 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红,亚铁离子被氧化为铁离子,
向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红,亚铁离子被氧化为铁离子,
![]() 取a中红色溶液少量,溶液中存在平衡,
取a中红色溶液少量,溶液中存在平衡,![]() ,加入过量Pb,和平衡状态下铁离子反应生成亚铁离子,平衡逆向进行充分反应后,红色褪去,
,加入过量Pb,和平衡状态下铁离子反应生成亚铁离子,平衡逆向进行充分反应后,红色褪去,
(3)因为Ksp(PbCO3)=3.3×10-14和c(CO32-)=0.1molL-1,可知c(Pb2+)=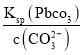 =
=![]() mol/L=3.3×10-13 mol/L , 因此Qc= c(Pb2+) c(SO42-)=3.3×10-13×1.6=5.28×10-13< Ksp(PbSO4),说明PbSO4在母液中未饱和,即PbCO3中不混有PbSO4;
mol/L=3.3×10-13 mol/L , 因此Qc= c(Pb2+) c(SO42-)=3.3×10-13×1.6=5.28×10-13< Ksp(PbSO4),说明PbSO4在母液中未饱和,即PbCO3中不混有PbSO4;
(4)①根据钠离子向阴极移动知,b为阴极,与电源负极相连;
②电解过程中,PbO2在阴极得电子,发生还原反应,电极反应式为![]() ;
;
③钠离子交换膜只允许钠离子通过,阻止HPbO2-进入阳极室被氧化,从而提高Pb元素的利用率;

【题目】室温下(20oC))课外小组用下列装置探究铁和硝酸反应情况,过程如下图所示:

将Ⅲ中液面上的气体排入小试管中点燃,有尖锐爆鸣声,小试管壁出现液滴。取反应后溶液,加入足量NaOH 溶液得到灰绿色沉淀。煮沸时,蒸气带有刺激性气味并能使湿润红色石蕊试纸变蓝。
(1)X气体是______ (填化学式),证据是________。
(2)实验中硝酸被还原成另一种产物的化学方程式_____。
(3)甲同学对产生的气体原因提出假设并设计方案:
假设1:该浓度的硝酸中H+的氧化性大于NO3-
假设2:H+还原反应速率大于NO3-的还原反应速率
I. 验证假设1:可用____(选 “ Cu” 或“Zn”)粉与同浓度硝酸反应,依据 ____________ ,则假设1不成立。
II. 验证假设2:改变条件重复上图过程实验,结果如下:(所用试剂的量、气体成分与实验上图相同)
序号 | 反应温度 | 实验结果 |
a | 40oC | 溶液浅绿色,收集气体为3.4mL |
b | 60oC | 溶液浅绿色,收集气体为2.6mL |
上表实验结果_____(填“能”或“否”)判断假设2成立。由实验数据结果分析温度对铁粉与硝酸反应时对生成X体积的影响的原因___________。
(4)常温下(20℃),乙同学改用3mol·L–1 HNO3 进行图1过程实验,Ⅱ中仍为无色气体,在Ⅲ中气体变红色。由此得出的相关结论正确的是______ 。
a. 该实验产生的无色气体只有NO
b. 若改用浓硝酸时,反应会更剧烈还原产物为NO2
c. 硝酸的浓度不同时,其主要还原产物不同
(5)综上所述,金属与硝酸生成X气体,需要控制的条件是___________ 。
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)已知反应②中相关化学键键能数据如下:
化学键 | H-H | C=O | C≡O | H-O |
E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=____kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____kJ·mol-1。
(2) 一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
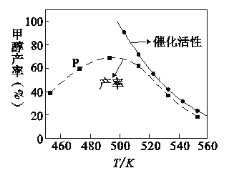
①温度为470K时,图中P点____(填“是”或“不是”)处于平衡状态,490K之后,甲醇产率随温度升高而减小的原因除了升高温度使反应①平衡逆向移动以外,还有___________________________________________________________、______________________________________________________________________。
②一定能提高甲醇产率的措施是______。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
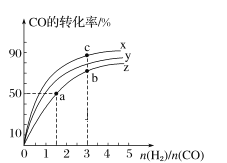
(3)如图为一定比例的CO2+H2,CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。
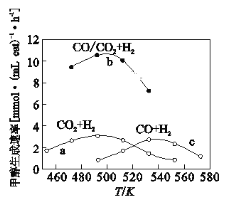
①490K时,根据曲线a、c判断合成甲醇的反应机理是______(填I或II)
Ⅰ.CO2![]() CO
CO![]() CH3OH
CH3OH
II.CO![]() CO2
CO2![]() CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,结合反应①、②分析原因___________________________。