题目内容
【题目】某实验小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
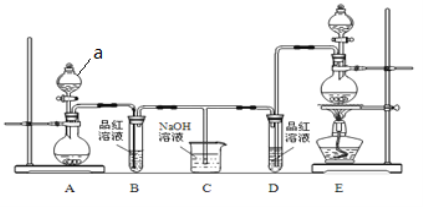
(1)仪器a的名称是____。
(2)利用图中A装置进行实验室制备SO2的化学方程式是____。
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色。停止通气后,给B、D两支试管中的液体加热,试管中现象是:B__;D___。据此,说明SO2的漂白特点是_____。
(4)装置C的作用是_______。
(5)将等物质的量的SO2和Cl2同时通入水中,所得水溶液没有漂白性的原因是(用离子方程式表示)________。要检验此时溶液中生成的负一价阴离子,方法是_____(要求答出具体实验操作、现象及结论)。
【答案】分液漏斗 Na2SO3 +H2SO4=Na2SO4 +SO2↑+H2O 恢复红色 仍为无色 可逆性(受热可复原) 吸收多余SO2、Cl2,防止污染空气 SO2+Cl2+2H2O=4H++SO42-+2Cl- 取样,加入过量的Ba(NO3)2溶液,静置,取上层清液,加入AgNO3溶液,若有白色沉淀生成,则溶液中有Cl-
【解析】
(1)根据仪器的构造可知仪器a的名称是分液漏斗,故答案为:分液漏斗。
(2)实验室中常用亚硫酸钠跟浓硫酸起反应制取二氧化硫,反应的化学方程式是Na2SO3+H2SO4=Na2SO4 +SO2↑+H2O,故答案为:Na2SO3 +H2SO4=Na2SO4 +SO2↑+H2O。
(3)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时能重新变成红色,故答案为:恢复红色,仍为无色,可逆性(受热可复原)。
(4)氯气和二氧化硫均是大气污染物,需要尾气处理,则装置C的作用是吸收多余SO2、Cl2,防止污染空气,故答案为:吸收多余SO2、Cl2,防止污染空气。
(5)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性,反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-;溶液中生成的负一价阴离子为Cl-,检验Cl-的方法为:取样,加入过量的Ba(NO3)2溶液,静置,取上层清液,加入AgNO3溶液,若有白色沉淀生成,则溶液中有Cl-,故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;取样,加入过量的Ba(NO3)2溶液,静置,取上层清液,加入AgNO3溶液,若有白色沉淀生成,则溶液中有Cl-。