题目内容
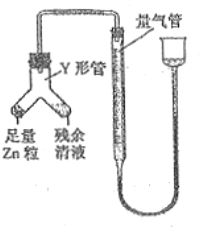
【题目】某兴趣小组利用下列装置,进行与氯气相关的实验。
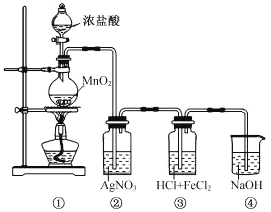
(1)装置④中NaOH溶液的作用是___________。
(2)实验结束后,取装置③中的溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到FeCl3·6H2O晶体。在蒸发浓缩操作中,不需要的仪器是___________。
A.蒸发皿 B.漏斗 C.玻璃棒 D.酒精灯
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2___________________,请说明理由_______________________________________。
【答案】吸收氯气 B 否 浓盐酸挥发出的氯化氢也能与硝酸银反应,也能出现白色沉淀
【解析】
装置①为氯气制备装置,装置②中氯气和挥发出的氯化氢能与硝酸银反应生成白色沉淀,装置③氯气能够将氯化亚铁氧化生成氯化铁,装置④中氢氧化钠溶液吸收有毒的氯气,防止污染环境。
(1)装置④中NaOH溶液的作用是吸收有毒的氯气,防止污染环境,故答案为:吸收氯气;
(2)在蒸发浓缩操作中,需要用到的仪器有蒸发皿、三脚架、玻璃棒、酒精灯,不需要漏斗,故答案为:B;
(3)氯气与水反应生成盐酸和次氯酸,盐酸与硝酸银反应,生成氯化银白色沉淀,由于盐酸具有挥发性,氯气中混有的挥发出的氯化氢也能与硝酸银反应,生成氯化银白色沉淀,因此不能依据装置②中出现白色沉淀推测装置①中生成Cl2,故答案为:否;浓盐酸挥发出的氯化氢也能与硝酸银反应,也能出现白色沉淀。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是____________(填标号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔点/°C | 1570 | 2800 | 23.8 | 75.5 |
解释表中氧化物之间熔点差异的原因__________。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=__________pm,Mg原子之间最短距离y=__________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是__________g·cm3(列出计算表达式)。


【题目】对于下列实验现象的解释,不合理的是
实验 | 现象 | 解释 | |
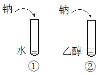
A | | ②中产生气体的速率比①慢 | 乙醇分子中,乙基对羟基产生影响,使O—H键不容易断裂 |
B |
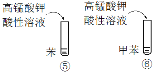
| ③中振荡静置后分层,上层为橙色;④中产生白色沉淀 | 苯酚分子中,苯环对羟基产生影响,使O—H键更容易被取代 |
C |
| ⑤中振荡静置后分层,下层为紫色溶液;⑥中振荡后紫色溶液褪色 | 甲苯分子中,苯环对甲基产生影响,使甲基上C—H更容易被氧化 |
D |
| 水浴加热,⑦中未见明显变化;⑧中试管壁上附着一层光亮的银 | 碱性条件下+1价的Ag才能氧化乙醛 |
A. A B. B C. C D. D