题目内容
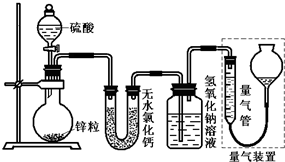 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10l kPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10l kPa,温度为0℃).(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是
A.200mL B.400mL C.500mL
(2)某同学认为:若1.30g锌粒完全溶解,只要测得氢氧化钠溶液洗气瓶增重l.28g,就可确定圆底烧瓶中发生反应的化学方程式为:
(3)若向烧瓶中加入a g锌,同时向烧瓶中加入了V1 ml浓硫酸,且锌完全反应,氢氧化钠洗气瓶增重b g.量气管中收集到V2ml气体,则有:a g/65g?mol-1=b g/64g?mol-1+(V2-V1)ml/22400ml?mol-1,依据的原理是
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重m g,则整个实验过程产生的气体中,n(H2)/n(SO2)=
(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①
分析:(1)根据锌的质量计算生成气体的体积,从而确定量气管的适宜规格;
(2)根据氢氧化钠的性质分析增重的原因,并写出相应的化学反应方程式,分析装置中气体流向不能全部被吸收分析判断;
(3)根据氧化还原反应的特点分析,1 mol锌无论用来产生SO2 还是产生氢气都是1 mol锌对应1 mol气体;
(4)根据氢氧化钠洗气瓶增重的量求出反应的硫酸的物质的量,硫酸总量减去生成二氧化硫需要的硫酸的量即为生成氢气的硫酸的量,继而求出生成气体的物质的量;根据无水氯化钙的作用分析;
(5)①根据化学反应与反应热的关系分析;②根据溶液的读数方法分析;③视线的位置分析.
(2)根据氢氧化钠的性质分析增重的原因,并写出相应的化学反应方程式,分析装置中气体流向不能全部被吸收分析判断;
(3)根据氧化还原反应的特点分析,1 mol锌无论用来产生SO2 还是产生氢气都是1 mol锌对应1 mol气体;
(4)根据氢氧化钠洗气瓶增重的量求出反应的硫酸的物质的量,硫酸总量减去生成二氧化硫需要的硫酸的量即为生成氢气的硫酸的量,继而求出生成气体的物质的量;根据无水氯化钙的作用分析;
(5)①根据化学反应与反应热的关系分析;②根据溶液的读数方法分析;③视线的位置分析.
解答:解:(1)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.448L
0.448L=448mL
故选C;
(2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,
Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O,该同学想法不合理,因为反应产生的SO2将有一部分留在烧瓶和导气管中,不能被NaOH 溶液所吸收的,因此NaOH 溶液增重一定会小于1.28 g,
故答案为:Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O.因为反应产生的SO2将有一部分留在烧瓶和导气管中,不能被NaOH 溶液所吸收的,因此NaOH 溶液增重一定会小于1.28 g;
(3)根据氧化还原知识或根据方程式,1 mol锌无论用来产生SO2 还是产生氢气都是1 mol锌对应1 mol气体,根据氧化还原反应中得失电子数相等列出式子,a g/65g?mol-1=b g/64g?mol-1+(V2-V1)ml/22400ml?mol-1,
故答案为:根据氧化还原知识或根据方程式1 mol锌无论用来产生SO2 还是产生氢气都是1 mol锌对应1 mol气体;
(4)Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
2mol 1mol
mol
mol
生成二氧化硫需要的硫酸为
mol;
Zn+H2SO4=ZnSO4+H2↑
1mol 1mol
( CV-
)mol (CV-
)mol
=
=
;
若撤走盛有无水氯化钙的U型管,混合气体中的水蒸气进入氢氧化钠溶液,导致洗气瓶增重量增大,所以计算时二氧化硫的物质的量增大,氢气与二氧化硫的物质的量之比偏小,
故答案为:
;偏小;
(5)因为该反应是放热反应,随着反应的进行,溶液的温度逐渐升高,生成的气体温度高于标况下温度,温度对气体体积有影响,所以要待冷却至室温才开始读数;在读数时,如果俯视或仰视都会造成误差,所以读数时眼睛视线与液面最低处相平,
故答案为:①待冷却至室温才开始读数;②读数前使量气管左右液面相平;③视线与量气管中液面的凹液面最低点在同一水平面.
1mol 22.4L
| 1.30g |
| 65g/mol |
0.448L=448mL
故选C;
(2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,
Zn+2H2SO4(浓)
| ||
故答案为:Zn+2H2SO4(浓)
| ||
(3)根据氧化还原知识或根据方程式,1 mol锌无论用来产生SO2 还是产生氢气都是1 mol锌对应1 mol气体,根据氧化还原反应中得失电子数相等列出式子,a g/65g?mol-1=b g/64g?mol-1+(V2-V1)ml/22400ml?mol-1,
故答案为:根据氧化还原知识或根据方程式1 mol锌无论用来产生SO2 还是产生氢气都是1 mol锌对应1 mol气体;
(4)Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
2mol 1mol
| m |
| 32 |
| m |
| 64 |
生成二氧化硫需要的硫酸为
| m |
| 32 |
Zn+H2SO4=ZnSO4+H2↑
1mol 1mol
( CV-
| m |
| 32 |
| m |
| 32 |
| n(H2) |
| n(SO2) |
(cV-
| ||
|
| 64cV-2m |
| m |
若撤走盛有无水氯化钙的U型管,混合气体中的水蒸气进入氢氧化钠溶液,导致洗气瓶增重量增大,所以计算时二氧化硫的物质的量增大,氢气与二氧化硫的物质的量之比偏小,
故答案为:
| 64cV-2m |
| m |
(5)因为该反应是放热反应,随着反应的进行,溶液的温度逐渐升高,生成的气体温度高于标况下温度,温度对气体体积有影响,所以要待冷却至室温才开始读数;在读数时,如果俯视或仰视都会造成误差,所以读数时眼睛视线与液面最低处相平,
故答案为:①待冷却至室温才开始读数;②读数前使量气管左右液面相平;③视线与量气管中液面的凹液面最低点在同一水平面.
点评:本题考查了排气量气装置,要注意的是锌和硫酸的反应,硫酸浓度不同时,锌和硫酸反应的生成物不同,表现氧化性的元素也不同.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃,锌的相对原子质量为65).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃,锌的相对原子质量为65).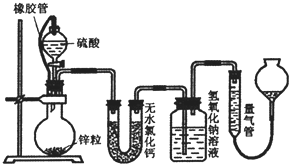 不同浓度的硫酸与锌反应时,硫酸可以被还原为S02,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.
不同浓度的硫酸与锌反应时,硫酸可以被还原为S02,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.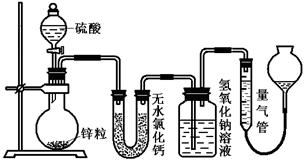
 应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的数值将
应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的数值将