题目内容
20.在一定温度下,在密闭的恒容容器中发生2A(g)?2B(g)+C(g),若开始时只充入2molA气体,达平衡时,测的混合气体的压强比反应前增大了20%,则平衡时A的体积分数为50%.分析 依据化学平衡三段式列式计算,设反应的A物质的量为x
2A(g)?2B(g)+C(g)
起始量(mol) 2 0 0
变化量(mol) x x 0.5x
平衡量(mol) 2-x x 0.5x
气体压强之比等于气体物质的量之比,
A的气体体积分数等于气体物质的量分数=$\frac{A平衡物质的量}{平衡混合气体物质的量}$×100%.
解答 解:设反应的A物质的量为x,则
2A(g)?2B(g)+C(g)
起始量(mol) 2 0 0
变化量(mol) x x 0.5x
平衡量(mol) 2-x x 0.5x
气体压强之比等于气体物质的量之比,达平衡时,测的混合气体的压强比反应前增大了20%,
(2-x+x+0.5x)=2+2×20%
x=0.8mol
A的气体体积分数等于气体物质的量分数=$\frac{A平衡物质的量}{平衡混合气体物质的量}$×100%=$\frac{2mol-0.8mol}{2mol+0.5×0.8mol}$×100%=50%;
故答案为:50%.
点评 本题考查了化学平衡的三段式计算,主要是气体压强之比等于气体物质的量之比的计算分析,掌握基础是关键,题目较简单.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6 L 氟化氢中含有氟原子的数目为1.5NA | |
| B. | pH均为5的NH4Cl和NaHSO4溶液中水电离出的氢离子数目均为10-5NA | |
| C. | 在1L 0.1 mol•L-1CuSO4溶液中,阴离子总数大于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molIH2,在一定条件下充分反应,转移电子的数目为 NA |
8.己知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.12×10-12,下列叙述正确的是( )
| A. | 向氯化银的浊液中加入氯化钠溶液,氯化银的溶解度减小 | |
| B. | 向2.0×10-1mol/L的K2CrO4溶液中加入等体积的2.0×10-1mol/LAgNO3溶液,则有Ag2CrO4沉淀生成 | |
| C. | 将一定量的AgCl和Ag2CrO4固体棍合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大 | |
| D. | 将0.001 mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001 mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
15.A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素的名称N、S、F;
(2)B位于元素周期表中第三周期,第ⅥA族;
(3)C的原子结构示意图为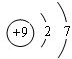 ,比较B、C的原子半径:B>C;
,比较B、C的原子半径:B>C;
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
| A | C | |
| B |
(2)B位于元素周期表中第三周期,第ⅥA族;
(3)C的原子结构示意图为
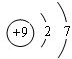 ,比较B、C的原子半径:B>C;
,比较B、C的原子半径:B>C;(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
5.反应2A(g)+5B(g)?4C(g)+6D(g)在1L密闭容器中进行,0.5min后,A减少了0.90mol,则此反应的速率可表示为( )
| A. | v(A)=3.6mol/(L•s) | B. | v(B)=0.075mol/(L•s) | C. | v(C)=0.030mol/(L•s) | D. | v(D)=0.060mol/(L•s) |
12.在锌铜原电池中,当导线中有1mole-通过时,从理论上分析,两极的变化是( )
①锌片溶解了32.5g ②锌片增重了32.5g
③铜片上析出1g氢气 ④铜片上析出1mol氢气.
①锌片溶解了32.5g ②锌片增重了32.5g
③铜片上析出1g氢气 ④铜片上析出1mol氢气.
| A. | ①和③ | B. | ①和④ | C. | ②和③ | D. | ②和④ |
9.将某溶液逐滴加入Al(OH)3溶胶内,开始产生沉淀,继续滴加时沉淀又溶解,该溶液是( )
| A. | 2 mol/L NaOH的溶液 | B. | 2 mol/L Na2SO4的溶液 | ||
| C. | 2 mol/L MgSO4的溶液 | D. | FeCl3溶液 |
10.现有8中元素的性质、数据如下表所列,它们属于第二或第三周期
回答下列问题:(用元素符号或化学式填写)
(1)②的元素符号是Be;③的元素名称是硼;①在元素周期表中的位置是(周期,族)第二周期ⅥA族;⑧的离子结构示意图:
(2)比较⑤和⑥的最高价氧化物对应水化物的酸性大小:HClO4>HNO3;
(3)比较⑥和⑦的氢化物的稳定性:NH3>SiH4;⑥的氢化物电子式为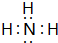 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
(4)写出⑥的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4HNO3
(5)写出⑧的最高价氧化物对应水化物跟短周期中碱性最强的氢氧化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)④的氢化物与⑤的单质(体积比为1:2)在光照条件下反应,生成的有机产物有4种,其中常温下是气体的是CH3Cl,含有4个相同极性键的是CCl4.
| 元素性质 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 0.89 | 0.82 | 0.77 | 0.99 | 0.75 | 1.17 | 1.43 |
| 最高或最低化合价 | +2 | +3 | +4 | +7 | +5 | +4 | +3 | |
| -2 | -4 | -1 | -3 | -4 |
(1)②的元素符号是Be;③的元素名称是硼;①在元素周期表中的位置是(周期,族)第二周期ⅥA族;⑧的离子结构示意图:

(2)比较⑤和⑥的最高价氧化物对应水化物的酸性大小:HClO4>HNO3;
(3)比较⑥和⑦的氢化物的稳定性:NH3>SiH4;⑥的氢化物电子式为
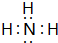 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);(4)写出⑥的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4HNO3
(5)写出⑧的最高价氧化物对应水化物跟短周期中碱性最强的氢氧化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)④的氢化物与⑤的单质(体积比为1:2)在光照条件下反应,生成的有机产物有4种,其中常温下是气体的是CH3Cl,含有4个相同极性键的是CCl4.