题目内容
已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625 kJ·g-1。下列热化学方程式中不正确的是( )
A.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH ="-890" kJ/mol CO2(g)+2H2O(l) ΔH ="-890" kJ/mol |
B.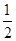 CH4(g)+O2(g) CH4(g)+O2(g) 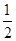 CO2(g)+H2O(l) ΔH="-445" kJ/mol CO2(g)+H2O(l) ΔH="-445" kJ/mol |
C.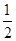 CO2(g)+H2O(l) CO2(g)+H2O(l) 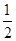 CH4(g)+O2(g) ΔH="+445" kJ/mol CH4(g)+O2(g) ΔH="+445" kJ/mol |
D.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH="-55.625" kJ/mol CO2(g)+2H2O(l) ΔH="-55.625" kJ/mol |
D
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是:
| A.甲烷的标准燃烧热为△H=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1 |
| B.已知H2O(l)= H2O(g)△H="+44" kJ·mol-1, 则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的能量 |
| C.常温下,反应C(s)+CO2(g)=CO(g)不能自发进行,则该反应的△H <O |
| D.同温同压下,H2(g)+ Cl2 (g)="2HCl" (g)在光照和点燃条件下的△H相同。 |
下列图示与对应的叙述相符的是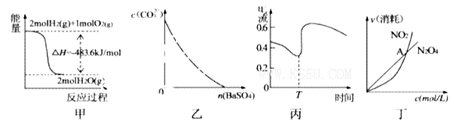
A.图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483. 6kJ |
| B.图乙表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
| C.图丙表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2 |
D.图丁表示恒温恒容条件下发生的可逆反应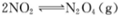 中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
下列说法中不正确的是
| A.开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 |
| B.钢铁是用量最大、用途最广泛的合金 |
| C.硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 |
| D.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 |
已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH1=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH2=-57.3 kJ·mol-1
③Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH3<0
下列说法正确的是( )
| A.HF的电离方程式及热效应:HF(aq)=H+(aq)+F-(aq) ΔH>0 |
| B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 |
| C.ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 |
| D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-1 |
热化学方程式C(s)+H2O(g) CO(g)+H2(g) ΔH="+131.3" kJ·mol-1表示的
CO(g)+H2(g) ΔH="+131.3" kJ·mol-1表示的
为( )
| A.碳与水反应吸收131.3 kJ的热量 |
| B.1 mol碳和1 mol水反应吸收131.3 kJ的热量 |
| C.1 mol固态碳与1 mol水蒸气反应产生一氧化碳气体和氢气,吸收131.3 kJ的热量 |
| D.固态碳和气态水各1 mol反应,放出131.3 kJ的热量 |
下列说法不正确的是( )
| A.反应是放热还是吸热必须看生成物和反应物所具有的总能量的相对大小 |
| B.绿色植物进行光合作用时,将太阳能转化为化学能储存起来 |
| C.吸热反应中由于反应物总能量小于生成物总能量,因而无利用价值 |
| D.物质的化学能可以在一定条件下转化为热能、电能为人类所利用 |
下列说法中错误的是( )
| A.电解饱和食盐水,生成物总能量比反应物总能量高 |
| B.化学反应过程中,发生物质变化的同时一定发生能量变化 |
| C.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高 |
| D.食盐可用于融化冰雪,且用食盐作融雪剂不会对环境、植物生长产生任何危害 |
反应A(g)+B(g)→C(g) ΔH,分两步进行:①A(g)+B(g)―→X(g) ΔH1 ②X(g)―→C(g) ΔH2,反应过程中能量变化如图所示,E1表示A+B―→X的活化能,下列说法正确的是( )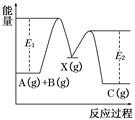
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)―→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |