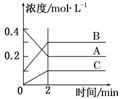
题目内容
醋酸溶液中存在电离平衡:
CH3COOH H++CH3COO-,下列叙述不正确的是 ( )
H++CH3COO-,下列叙述不正确的是 ( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.12mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
【答案】B
【解析】根据电荷守恒,可得:c(H+)=c(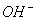 )+C(
)+C(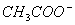 ),故A项对;0.1mol/lCH3COOH在加水稀释过程中酸性减弱,即c(H+)减小,而在一定温度下,C(H+)·C(
),故A项对;0.1mol/lCH3COOH在加水稀释过程中酸性减弱,即c(H+)减小,而在一定温度下,C(H+)·C(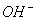 )=Kw是一定值,故c(
)=Kw是一定值,故c(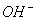 )增大,所以B错;在醋酸中加入醋酸钠,c(
)增大,所以B错;在醋酸中加入醋酸钠,c(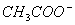 )增大,所以平衡向左移动,故C对;pH=2的CH3COOH中pH=12的NaOH中c(H+)=c(
)增大,所以平衡向左移动,故C对;pH=2的CH3COOH中pH=12的NaOH中c(H+)=c(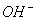 ),但由于醋酸是弱酸,部分电离,故醋酸的物质的量浓度大于NaOH,二者等体积混合后,醋酸过量,所以溶液显酸性,即pH<7,所以D对
),但由于醋酸是弱酸,部分电离,故醋酸的物质的量浓度大于NaOH,二者等体积混合后,醋酸过量,所以溶液显酸性,即pH<7,所以D对
规律:
(1)弱酸在加入水稀释的过程中H+与弱酸根离子的浓度都在减小,只有对应的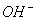 浓度在增加(如果改成氨水讨论的方法相同)
浓度在增加(如果改成氨水讨论的方法相同)
(2)PH之和为14的酸与碱等体积混合后,若都是强的则呈中性,若有弱的溶液呈弱的一方的性质,(把选项D的溶液改为氨水与盐酸同样讨论,若使溶液呈中性则加入的弱的一方的体积应该少)

练习册系列答案
相关题目
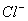 + 2H+
+ 2H+  H2↑+ Cl2↑
H2↑+ Cl2↑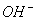

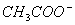 +
+ 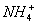 +3NH3 + 3Ag↓+ H2O
+3NH3 + 3Ag↓+ H2O 2C6H5OH + 2
2C6H5OH + 2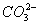
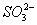 + 6H+ + 2MnO4- == 5
+ 6H+ + 2MnO4- == 5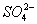 + 2Mn2+ 3H2O
+ 2Mn2+ 3H2O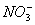 、Na+、
、Na+、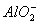 、
、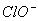 B.Mg2+、、
B.Mg2+、、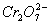 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料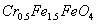 (
(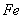 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程: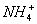 )+c(H+)=c(
)+c(H+)=c(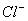 )
) 2B(g) +C(g)
2B(g) +C(g)