��Ŀ����
����Ŀ���������Ʊ��ߴ������ᡢ��Ļ����ȼ�յ��ȵ���Ҫԭ�ϣ���ҵ���Ʊ�����ԭ��֮һΪ4Ca5 ��PO4��3F+21Si02+30C3P4+20GaSiO3+30CO��+SiF4 �� �ش�������⣺
��1����̬��ԭ�ӵļ۲�����Ų�ͼΪ �� ������Ӧ�漰�ĵڶ�����Ԫ���е�һ�������ɴ�С��˳��Ϊ����Ԫ�ط��ű�ʾ����
��2�����������У�����ԭ���ӻ��������Ϊsp3�ķ����� �� SiF4���ӹ���Ϊ �� ��������C�ľ������ͣ���������Ӧ������ʧ�ľ�������Ϊ ��
��3��̼����ͬһ���壬CF4�е��SiF4�͵�ԭ������̼���γɦм��������γɦм�����Ҫԭ���� ��
��4��ͼ1Ϊ����Ԫ���γɵ�һ�ַ��ӣ�������ÿ��ԭ���������ﵽ8�����ȶ��ṹ���û�����ķ���ʽΪ �� ���侧���з��ӵĶѻ���ʽ��ɱ���ͬ��������ÿ�����ӵ���λ���� �� 
��5��̼��������Ԫ���γɵ�һ�ָ�Ӳ�Ȼ�����ľ�����ͼ2��ʾ�����û�������ܶ�Ϊ��gcm3 �� ��������Ϊa pm����٤������Ϊmol��1 ��
���𰸡�
��1��![]() ��F��O��C
��F��O��C
��2��P4��SiF4���������壻ԭ�Ӿ���
��3��CF4��SiF4���Ƿ��Ӿ��壬�ṹ���ƣ�SiF4���Ӽ�����������CF4����ԭ�Ӱ뾶��̼ԭ�Ӱ뾶��
��4��P4S3��12
��5��![]()
���������⣺��1��P��15��Ԫ�أ��������5�����ӣ����۲���5�����ӣ����Լ۲���ӵ��Ų�ͼΪ ![]() ������Ԫ���У�λ�ڵڶ����ڵ�Ԫ��ΪC��O��F��ͬ������ԭ����������Ԫ�ص�һ�����ܳ��������ƣ�ע���A����A��Ԫ�ص�һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������F��O��C�����Դ��ǣ�
������Ԫ���У�λ�ڵڶ����ڵ�Ԫ��ΪC��O��F��ͬ������ԭ����������Ԫ�ص�һ�����ܳ��������ƣ�ע���A����A��Ԫ�ص�һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������F��O��C�����Դ��ǣ� ![]() ��F��O��C����2�����������У�P4�е���ԭ����Χ�����Թ��õ��ӶԺ�һ�Թµ��Ӷԣ�SiF4�й�ԭ����Χ���ĶԹ��õ��Ӷԣ�����sp3�ӻ���SiF4�й�ԭ����Χ���ĶԹ��õ��Ӷԣ�û�йµ��Ӷԣ����Է��ӹ���Ϊ�������壬����������Ӧ��֪����Ӧ���ж�������Ϊԭ�Ӿ��壬����������û��ԭ�Ӿ��壬������ʧ�ľ�������Ϊԭ�Ӿ��壬
��F��O��C����2�����������У�P4�е���ԭ����Χ�����Թ��õ��ӶԺ�һ�Թµ��Ӷԣ�SiF4�й�ԭ����Χ���ĶԹ��õ��Ӷԣ�����sp3�ӻ���SiF4�й�ԭ����Χ���ĶԹ��õ��Ӷԣ�û�йµ��Ӷԣ����Է��ӹ���Ϊ�������壬����������Ӧ��֪����Ӧ���ж�������Ϊԭ�Ӿ��壬����������û��ԭ�Ӿ��壬������ʧ�ľ�������Ϊԭ�Ӿ��壬
���Դ��ǣ�P4��SiF4���������壻ԭ�Ӿ��壻��3��̼����ͬһ���壬CF4��SiF4���Ƿ��Ӿ��壬�ṹ���ƣ�SiF4����Է�����������CF4 �� SiF4���Ӽ�����������CF4 �� ����SiF4�е�ߣ���ԭ�Ӱ뾶��̼ԭ�Ӱ뾶�����Թ��̼���γɦм���
���Դ��ǣ�CF4��SiF4���Ƿ��Ӿ��壬�ṹ���ƣ�SiF4���Ӽ�����������CF4����ԭ�Ӱ뾶��̼ԭ�Ӱ뾶��4������ͼ1��֪��������ÿ��ԭ���������ﵽ8�����ȶ��ṹ���������Ϊ��ԭ�ӣ�ʵ����Ϊ��ԭ�ӣ����Ըû�����ķ���ʽΪP4S3 �� ���ݸɱ������Ľṹ��֪��ÿ��������̼������Χ��������Ķ�����̼������12�������Ծ�����ÿ�����ӵ���λ����12��
�ʴ𰸣�P4S3��12����5�����ݾ����Ľṹͼ��֪�������к��е�̼ԭ����Ϊ4����ԭ����Ϊ ![]() =4������
=4������  ��֪��NA=
��֪��NA= ![]() mol��1=
mol��1= ![]() mol��1 ��
mol��1 ��
���Դ��ǣ� ![]() ��
��

 ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�����Ŀ������ʯ����Կ�����MgO��Fe2O3��Al2O3��SO2��ɣ�������ʯ��ȡ��ʽ̼��þ��ʵ�鲽����ͼ1�� 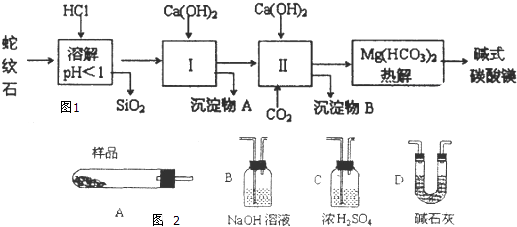
��1������ʯ��������ܽ����Һ�����Mg2+�⣬�����еĽ��������� ��
��2������I����ʱ��������Һ��pH=7.8���й��������������pH���±�����Ca��OH��2���ܹ�������Ca��OH��2�������ܻᵼ���ܽ⣬����������
�������� | Fe��OH��3 | Al��OH��3 | Mg��OH��2 |
��ʼ����pH | 1.9 | 3.3 | 9.4 |
������ȫʱPH | 3.2 | 5.4 | 12.4 |
��3���ӳ��������A����ȡ��ɫ��������Ϊ���ϣ����������A�м��루���������ʵĻ�ѧʽ����Ȼ���������գ���ʵ��������ƣ������ղ��������н��У���д�������ƣ�������ʵ���У�����ѭ�����õ����������ѧʽ����
��4�������ʵ�飬ȷ����ƷaMgCO3bMg��OH��2cH2O��a��b��c��ֵ����д������ʵ�鲽��������Ҫ�ⶨ����Ŀ�������Լ���Ũ���ᡢ��ʯ�ҡ�����������Һ������ʯ��ˮ��������Ʒ�������ڸ��·ֽ⣬�۲��ˮ�������������� �� �ݳ���MgO��������
��5������������ͼ2�У�װ�б�Ҫ���Լ�����ѡ���������ʵ�������������������һ��װ����ѡ���������ţ����ظ�ʹ�ã��á�A��B����������ʾ��
��6��18.2g��Ʒ��ȫ�ֽ����6.6gCO2��8.0gMgO���ɴ˿�֪����Ʒ�Ļ�ѧʽ�� a= �� b= �� c= ��
